Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Guyane:
- citron
- citron vert
Vénézuéla:
- lima
- limón
- limón agrio
Colombie:
- lima
- limón
- limón agrio
Porto Rico:
- lima
- limón
- limón agrio
Honduras:
- lima
- limón
- limón agrio
Panama:
- lima
- limón
- limón agrio
Trinité-et-Tobago:
- lime
Dominique:
- lime
République dominicaine:
- limón, limón agrio, lima
Martinique:
- sitron-vè
- sitwon péyi
Guadeloupe:
- sitron-vè
- sitwon péyi
- sitwon péyi
- ti sitwon vè
Saint-Martin:
- sitron-vè
- sitwon péyi
Haïti:
- sitwon péyi
- ti sitwon vè
Autres noms vernaculaires
Haïti:
- Citron
- Korosòl
- Sitron
- Sitwom
- Sitwon
Guadeloupe:
- Citron
- citron
- Citron pays
- Citron-Pays (sitwon péyi)
Saint-Martin:
- Citron
Dominique:
- Citron
- Lime
- Limes (citron)
Guyane:
- Citron
- situru
Trinité-et-Tobago:
- Lime
Nicaragua:
- Limón
Colombie:
- Limón
Panama:
- Limón
- limon
- NA
Cuba:
- Limón
Porto Rico:
- Limón
République dominicaine:
- Limón
- Limón agrio
Vénézuéla:
- Limón
Honduras:
- Limón
Martinique:
- sitwon, citronnier
Distribution géographique
Originaire d’Asie, cultivée dans les régions tropicales et subtropicales.
Description botanique
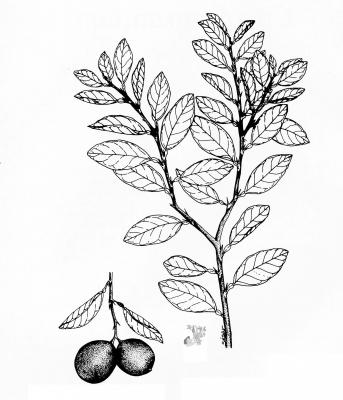
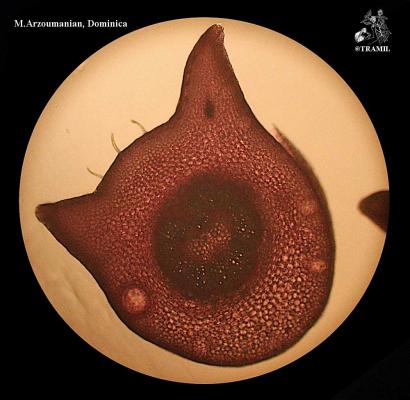
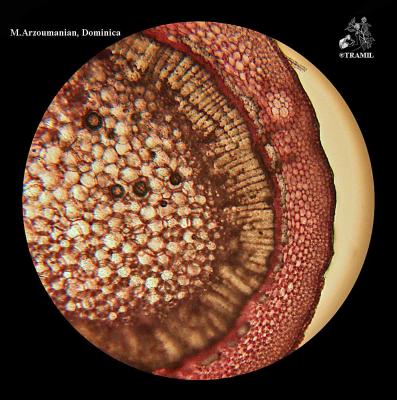
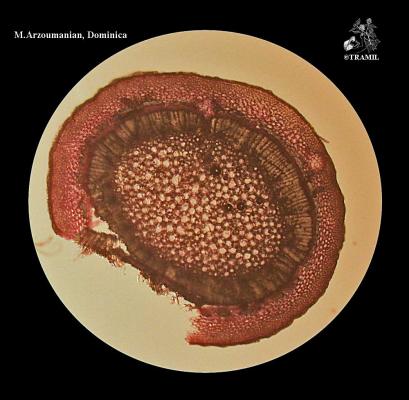
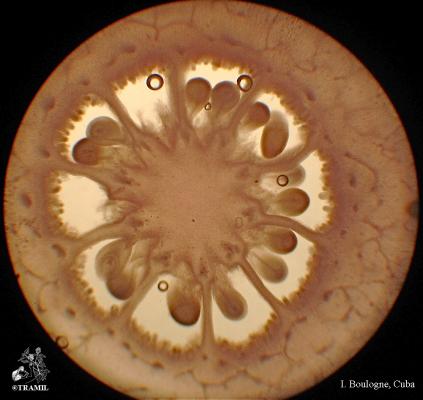
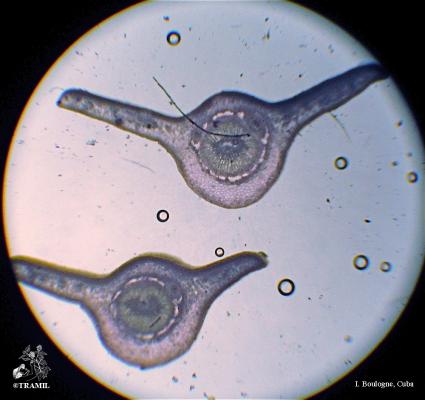
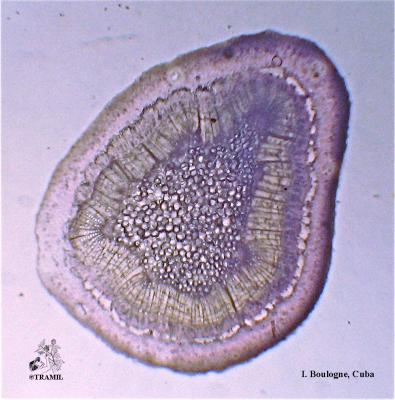
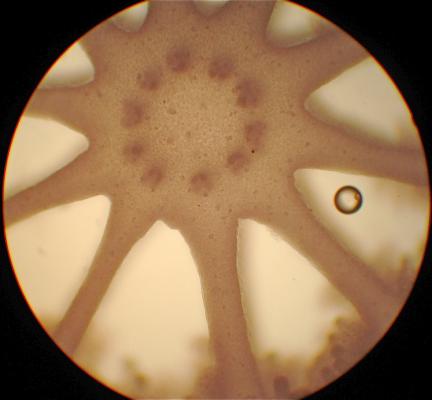
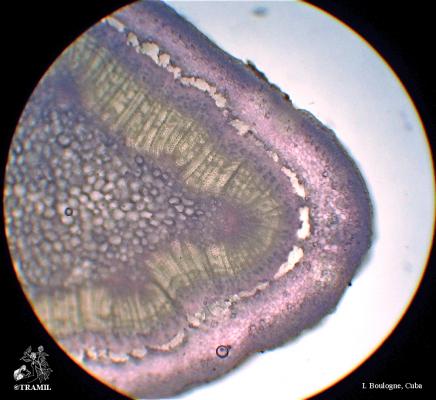
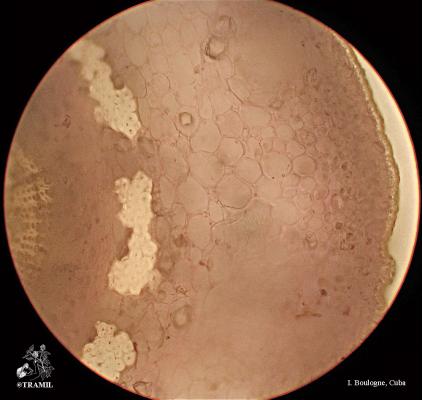
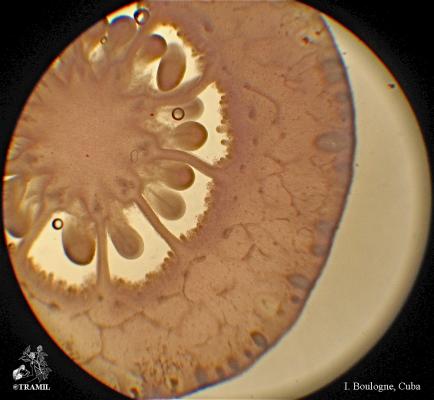
Arbuste aux branches irrégulières, armé de fortes épines, rigides et coupantes. Feuilles de 5 à 7,5 cm de long, elliptico-ovales, crénelées; pétioles en forme d’aile. Fleurs blanches de 2 cm de long. Fruits ronds de 3 à 6 cm, vert jaune, avec une abondante pulpe acide. Pépins blancs, ovales.
Voucher(s)
Rouzier,172,SOE
Jean Pierre,313,SLNH
Jiménez,1499,JBSD
Ochoa,234,HPMHV
Mejía,17,MAPR
Espinosa,5960,FLORPAN
Rios,1100,CECALLI
Delaigue,9,NHTT
Longuefosse&Nossin,129,HAVPM
Boulogne,TH, 9, UAG
Boulogne,TB,6, UAG
Pharmacopée
Ed.3References
1 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
2 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
3 OCRISSE G, 2008
Enquête TRAMIL auprès de 250 familles de la moitié Est de la partie francophone de St Martin. Biologie végétale, UAG, Guadeloupe.
4 BOULOGNE I, 2009
Enquête TRAMIL, (Terre-de-Bas et Terre-de-Haut) Les Saintes, UAG, Guadeloupe.
5 LAGOS-WITTE S, 1988-89, 1996
Encuesta TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
6 SolIs PN, Espinosa A, De Gracia J, Martínez L, Gupta MP, 2003
Encuesta TRAMIL (Emberá-Wounaann). Centro de Investigaciones Farmacognósticas de la Flora Panameña, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
7 HERRERA J, 1994
Encuesta TRAMIL (Costa atlántica). Laboratorio de Fitofarmacología, Departamento de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
8 HAY YO, 1998
Enquête TRAMIL (St. Georges). Institut de Recherche pour le Développement IRD, Cayenne, Guyane.
9 EDOUARD JA, 1992
Enquête TRAMIL. Lycée agricole, Baie-Mahault, Guadeloupe.
10 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
11 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
12 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
13 BENEDETTI MD, 1994
Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
14 DELAIGUE J, 2005
TRAMIL survey. UAG & PRDI, Tobago House of Assembly, Scarborough, Tobago.
15 Zambrano LE, 2007
Encuesta TRAMIL en Guareguare, Miranda. UCV, Caracas, Venezuela.
16 BALZ E, BOYER A, BURAUD M, 2007
Enquête TRAMIL à Marie-Galante. U. Bordeaux 3, U. Paris XI Chatenay-Malabry, UAG, Guadeloupe.
17 EKUNDAYO O, BAKARE O, ADESOMOJU A, STAHL-BISKUP E, 1991
Volatile constituents of the leaf oil of Nigerian lime (Citrus aurantiifolia). J Essent Oil Res 3(2):119-120.
18 BEZANGER-BEAUQUESNE L, PINKAS M, TORCK M, 1986
Les plantes dans la thérapeutique moderne. 2 éd. Paris, France: Ed. Maloine.
19 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA, CRC Press. p45.
20 SAUVAIN M, KODJOED JF, BERGRAVE SJ, BONNEVIE O, DEDET JP, 1986
Plantes fébrifuges en médecine traditionnelle en Haïti et en République Dominicaine et thérapie du paludisme. Rapport TRAMIL. ORSTOM, Cayenne, Guyane Française.
21 OLMEDO D, RODRIGUEZ N, ESPINOZA A, VASQUEZ Y, GUPTA MP, 2005Ensayo antimicrobiano de algunas especies con usos significativos TRAMIL-Centroamérica. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
22 BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010
Evaluación de la actividad antimicrobiana del zumo del fruto fresco de Citrus aurantiifolia (Christm.) Swing. var. mexicana. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, C. Habana, Cuba.
23 FRIAS AI, GARCIA N, MOREJON Z, MORON F, VICTORIA MC, 2009
Efecto antiinflamatorio tópico del zumo puro del fruto fresco de Citrus aurantiifolia (Christm.) Swingle (limón) en el edema de la oreja inducido por aceite de Croton en ratones. Trabajo TRAMIL. Laboratorio Central de Farmacología. Universidad de Ciencias Médicas de La Habana.
24 NOGATA Y, YOZA KI, KUSUMOTO KI, KOHYAMA N, SEKIYA K, OHTA H, 1996
Screening for inhibitory activity of Citrus fruit extracts against platelet cyclooxygenase and lipoxygenase. J Agric Food Chem 44(3):725-729.
25 CACERES A, GIRON L, ALVARADO S, TORRES MF, 1987
Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharmacol 20(3):223-237.
26 LAM L, ZHENG B, 1991
Effects of essential oils on glutathione S-transferase activity in mice. J Agric Food Chem 39(4):660-662.
27 EL KELTAWI N, MEGALLA S, ROSS S, 1980
Antimicrobial activity of some Egyptian aromatic plants. Herbal Pol 26(4):245-250.
28 ADESINA S, 1982
Studies on some plants used as anticonvulsants in Amerindian and African traditional medecine. Fitoterapia 53:147-162.
29 GUPTA M, 1987
Essential oil: a new source of bee repellents. Chem Ind (London) 5:161-163.
30 HARTMAN JG, LIMBIRD ILE, Eds., 1996
Goodman & Gilman Las bases farmacológicas de la terapéutica, 9a ed. México, México: Mc Graw-Hill Interamericana.
31 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2005
Clases tóxicas agudas (CTA) de una decocción de corteza de fruto fresco de Citrus aurantiifolia (Christm.) Swing. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
32 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2005. Clases tóxicas agudas (CTA) de una decocción de hoja fresca de Citrus aurantiifolia (Christm.) Swing. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
33 PAZOS L, COTO T, CAIZA F, 2009
Toxicidad oral aguda, dosis repetida, en ratón, hoja fresca de Citrus aurantiifolia. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
34 PAZOS L, COTO T, CAIZA F, 2009
Toxicidad oral aguda, dosis repetida, en ratón, cáscara del fruto fresco de Citrus aurantiifolia. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
35 GarcIa-GONZÁLEZ M, BARBOZA CJ. 2005
Toxicidad aguda (5000 mg/kg) dosis repetida, en ratones, del extracto acuoso de hojas frescas de Citrus aurantiifolia. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
36 MARTINEZ MJ, LOPEZ M, MOREJON Z, BOUCOURT E, FUENTES V, MORON F, 2007
Irritabilidad dérmica (piel sana) primaria de zumo fresco de fruto de Citrus aurantiifolia (Christm) Swing var mexicana. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
37 LOPEZ M, MOREJON Z, MARTINEZ MJ, BACALLAO Y, FUENTES V, MORON F, 2009
Irritabilidad dérmica piel lesionada, dosis repetida de Citrus aurantifolia (Christm) Swing. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, Cuba, C. Habana.
38 PAZOS L, COTO T, CAIZA F, 2009
Irritación ocular, en conejos, del jugo fresco del fruto de Citrus aurantiifolia. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
39 BALA S, GROVER IS, 1989
Antimutagenicity of some Citrus fruits in Salmonella typhimurium. Mutat Res 222(3):141-148.
40 PELLECUER J, 1995
Aromaterapia y toxicidad de los aceites esenciales. Natura Medicatrix 37(8):36-40.