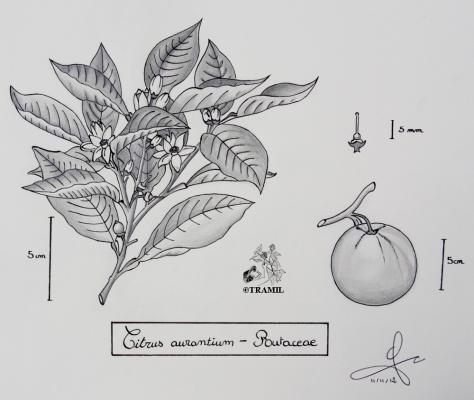
Citrus aurantium
Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Mexique:
- naranja agria
- naranja de babor
Porto Rico:
- naranja agria
- naranja de babor
Cuba:
- naranja agria
- naranja de babor
République dominicaine:
- naranja agria, naranja de babor
Martinique:
- oranger amer
- zowanj anmè
Grenade:
- sour orange
Haïti:
- zowanj gospo
- zowanj si
Distribution géographique
Originaire d’Asie, cultivée dans des régions tropicales et subtropicales.
Description botanique
Arbre pouvant atteindre 6 m de haut, à cime arrondie, avec des épines longues et plutôt souples. Feuilles de 7 à 10 cm, aiguës à acuminées; pétiole en forme d’aile prononcée. Fleurs axillaires de taille moyenne, blanches. Fruit de 7 à 8 cm de diamètre, de forme arrondie, un peu aplati au sommet, avec 10 à 12 segments; pulpe acide.
Voucher(s)
Jiménez,1507,JBSD
Medina,2,CICY
Benedetti,3,MAPR
Fuentes,946,ROIG
Ríos,409,CECALLI
Longuefosse&Nossin,13,HAVPM
Pharmacopée
Ed.3References
1 MOREJON Z, LOPEZ M, GARCIA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORON F, BOULOGNE I, ROBINEAU L, 2009
Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Ciudad de La Habana, Cuba.
2 MENDEZ M, MEDINA ML, DURAN R, 1996
Encuesta TRAMIL. Unidad de recursos naturales, Centro de Investigación Científica de Yucatán CICY, Mérida, México.
3 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
4 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
5 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
6 MARCELLE G, 1996
TRAMIL survey. Produce chemist laboratory, Ministry of Agriculture, St George's, Grenada.
7 BENEDETTI MD, 1994
Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
8 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
9 LIN Z, HUA Y, GU Y, 1986
The chemical constituents of the essential oil from the flowers, leaves and peels of Citrus aurantium. Chih Wu Hsueh Pao 28(6):635-640.
10 RIO JAD, BENAVENTE O, CASTILLO J, BORREGO F, 1992
Neodiosmin, a flavone glycoside of Citrus aurantium. Phytochemistry 31(2):723-724.
11 BENNETT RD, MIYAKE M, OZAKI Y, HASEGAWA S, 1991
Limonoid glucosides in Citrus aurantium. Phytochemistry 30(11):3803-3805.
12 WIDMER WW, 1991
Improvements in the quantitation of limonin in Citrus juice by reversed-phase high-performance liquid chromatography. J Agric Food Chem 39(8):1472-1476.
13 HERMAN Z, FONG CH, OU P, HASEGAWA S, 1990
Limonoid glucosides in orange juices by HPLC. J Agric Food Chem 38(9):1860-1861.
14 HOSODA K, NOGUCHI M, KANAYA T, HIGUCHI M, 1990
Studies on the preparation and evaluation of Kijitsu, the immature citrus fruits. III. Relation between diameter of Kijitsu and synephrine content. Yakugaku Zasshi 110(1):82-84.
15 BEZANGER-BEAUQUESNE L, PINKAS M, TORCK M, 1986
Les plantes dans la thérapeutique moderne. 2 éd. Paris, France: Ed. Maloine.
16 WAGNER H, BLADT S, MUNZING-VASITIAN K, 1975
Thin-layer chromatography of bitter principle drugs. Pharm-Ztg 120:1262.
17 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press, p45.
18 BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010
Evaluación de la actividad antimicrobiana del zumo del fruto fresco de Citrus aurantium L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, C. Habana, Cuba.
19 MORON FJ, MOREJON Z, GARCIA AI, LOPEZ M, BOUCOURT E, BACALLAO Y, FUENTES V, 2008
Acción analgésica de la decocción 30% de hojas frescas de Citrus aurantium L. (naranja agria) en ratones. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, Ciudad de La Habana, Cuba.
20 AVIRUTANT W, PONGPAL A, 1983
The antimicrobial activity of some Thai flowers and plants. Mahidol Univ J Pharm Sci 10(3):81-86.
21 CACERES A, GIRON LM, ALVARADO SR, TORRES MF, 1987
Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharmacol 20(3):223-237.
22 KIM DH, SONG MJ, BAE EA, HAN MJ, 2000
Inhibitory effect of herbal medicines on rotavirus infectivity. Biol Pharm Bull 23(3):356-358.
23 SANKAWA U, 1980
Screening of bioactive compounds in oriental medicinal drugs. Korean J Pharmacog 11:125-132.
24 KINOSHITA T, SAMESHIMA M, SANKAWA U, 1979
Isolation of a sympathomimetic substance from Chinese medicinal drugs originated from Citrus sp. Shoyakugaku Zassmi 33:146-149.
25 YOO JS, JUNG JS, LEE TH, SON KH, SUH HW, SONG DK, KIM YH, 1995
Inhibitory effects of extracts from traditional herbal drugs on 5-hydroxytryptophan-induced diarrhea in mice. Korean J Pharmacog 26(4):355-359.
26 FORSTER HB, NIKLAS H, LUTZ S, 1980
Antispasmodic effects of some medicinal plants. Planta Med 40(4):309-319.
27 IWAMA H, AMAGAYA S, OGIHARA Y, 1986
Effects of five kampohozais on the mitogenic activity of lipopolysaccharide, concanavalin A, phorbol myristate acetate and phytohemagglutinin in vivo. J Ethnopharmacol 18(2):193-204.
28 HIRANO H, TAKASE H, YAMAMOTO K, YANASE T, ABE K, SAITO Y, 1997
The anti-ulcer effects of Aurantii Fructus Immaturus, Aurantii Fructus and the principles in Aurantii Fructus Immaturus. Nat Med 51(3):190-193.
29 AZUMA S, YADA Y, IMOKAWA G, TAZAKI S, SHINHO T, 1996
Skin-lightening cosmetics containing plant extracts and ascorbic acid or placenta extracts. Patent-Japan Kokai Tokyo Koho-08 208,451.
30 AMEER B, WEINTRAUB RA, JOHNSON JV, YOST RA, ROUSEFF RL, 1996
Flavonone absorption after naringin, hesperidin, and Citrus administration. Clin Pharmacol Ther 60(1):34-40.
31 HARTMAN JG, LIMBIRD ILE, Eds., 1996
Goodman & Gilman las bases farmacológicas de la Terapéutica, 9a edición. México, México: McGraw-Hill Editorial. p1670-1671.
32 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2005
Clases tóxicas agudas (CTA) de una infusión de corteza de fruto fresco de Citrus aurantium L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
33 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2005
Clases tóxicas agudas (CTA) de zumo de fruto fresco de Citrus aurantium L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
34 GARCIA-GONZALEZ M, FALLAS LV, 2005
Toxicidad aguda dosis repetida, en ratones, del extracto acuoso (decocción) de las hojas frescas de Citrus aurantium . Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
35 PAZOS L, COTO T, CAIZA F, 2009 Irritación ocular, en conejos, del jugo fresco del fruto de Citrus aurantium. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
36 PENZAK SR, JANN MW, COLD JA, HON YY, DESAI HD, GURLEY BJ, 2001Seville (sour) orange juice: synephrine content and cardiovascular effects in normotensive adults. J Clin Pharmacol 41(10):1059-1063.
37 PARRA AL, YHEBRA RS, SARDINAS IG, BUELA LI, 2001Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
38 CALAPAI G, FIRENZUOLI F, SAITTA A, SQUADRITO F, ARLOTTA MR, COSTANTINO G, INFERRERA G, 1999Antiobesity and cardiovascular toxic effects of Citrus aurantium extracts in the rat: a preliminary report. Fitoterapia 70(6):586-592.
39 HOU YC, HSIU SL, TSAO CW, WANG YH, CHAO PD, 2000
Acute intoxication of cyclosporin caused by coadministration of decoctions of the fruits of Citrus aurantium and the pericarps of Citrus grandis. Planta Med 66(7):653-655.
40 SATO A, 1989
Studies on anti-tumor activity of crude drugs. I. The effects of aqueous extracts of some crude drugs in short term screening test. Yakugaku Zasshi 109(6):407-423.
41 YAMAMOTO H, MIZUTANI T, NOMURA H, 1982
Studies on the mutagenicity of crude drug extracts. I. Yakugaku Zasshi 102(6):596-601.
42 MORIMOTO I, WATANABE F, OSAWA T, OKITSU T, KADA T, 1982
Mutagenicity screening of crude drugs with Bacillus subtilis REC-assay and Salmonella microsome reversion assay. Mutat Res 97(2):81-102.
43 STOHS SJ, PREUSS HG, 2010
The safety of bitter orange (Citrus aurantium) and p-synephrine. HerbalGram 89:34-39.
44 CANIGUERAL S, VILA R, RISCO E, PEREZ F, PORTILLO A, FREIXA B, MILO B, VANACLOCHA B, RIOS JL, MORALES MA, ALONSO JR, BACHILLER LI, PERIS JB, STUBING G, 2002
Citrus aurantium. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Jul.20,2002. URL: www.masson.es/book/fitoterapia.html