Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Guatemala:
- barajo
République dominicaine:
- guajabo
Martinique:
- kasyalata
Vénézuéla:
- majagüillo
- tarantantán
Saint-Vincent-et-les-Grenadines:
- river grava
- river senna
Trinité-et-Tobago:
- wild guava
- wild senna
Distribution géographique
Originaire d’Amérique tropicale, cultivée sous les tropiques de l’Ancien Monde.
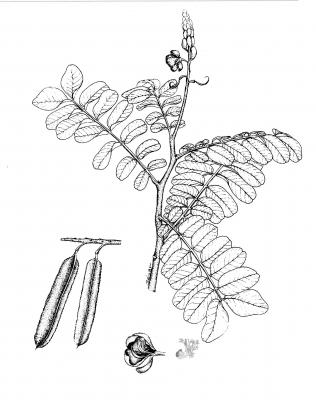
Description botanique
Arbuste pouvant atteindre 3 m de haut. Feuilles paripennées pouvant atteindre 70 cm de long; folioles de 6 à 14 paires, oblongs à obovés de 4 à 15 cm, émarginés. Grappes terminales avec de nombreuses fleurs de couleur jaune doré; sépales légèrement différents entre eux; 5 pétales presque égaux en forme d’ongle. Gousse aplatie linéaire avec 4 larges ailettes crénées; graine couleur café foncé à noires.
Voucher(s)
Delens,138,VEN
Longuefosse &Nossin,36,HAVPMC
Girón,154,CFEH
Jiménez,3528,JBSD
Balland,44,HVB
Delaigue,25,NHTT
Boulogne,TB,17,UAG
Pharmacopée
Ed.3References
1 DELENS M, 1990-92
Encuesta TRAMIL. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
2 DELAIGUE J, 2005
TRAMIL survey. PRDI, Tobago House of Assembly, Scarborough, Tobago.
3 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Asociation pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
4 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
5 BOULOGNE I, 2008
Enquête TRAMIL, Les Saintes (Terre-de-Bas), UAG, Guadeloupe (FWI).
6 CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003
Encuesta TRAMIL (región Este). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
7 BALLAND V, GLASGOW A, SPRINGER F, GAYMES G, 2004
TRAMIL survey. enda-caribbean, IICA, UAG & U.PARIS XI, Saint Vincent.
8 HARRISON J, GARRO C, 1977
Study on anthraquinone derivatives from Cassia alata L. (Leguminosae). Rev Per Bioquim 1(1):31-33.
9 MULCHANDANI N, HASSARAJANI S, 1975
Isolation of 1,3,8-trihydroxy-2-methylanthraquinone from Cassia alata (leaves). Phytochemistry 14:2728b.
10 HAUPTMANN H, NAZARIO L, LACERDA L, 1950
Some constituents of the leaves of Cassia alata. J Am Chem Soc 72(4):1492-1495.
11 RAO C, SUBHASHINI G, 1986
Saponins & leucoanthocyanins in Cassia L. Curr Sci 55(6):320-321.
12 SMOLENSKI S, SILINIS H, FARNSWORTH N, 1975
Alkaloid screening. Lloydia 38(3):225-255.
13 RAI M, UPADHYAY S, 1988
Screening of medicinal plants of Chindwara district against Trychophyton mentagrophytes: a causal organism of Tinea pedis. Hindustan Antibiot Bull 30(1/2):33-36.
14 FIALLO M, VAZQUEZ TINEO M, 1992
Evaluación in vitro de plantas usadas en afecciones de la piel: Extractos vegetales antimicóticos y antimicrobianos. Informe TRAMIL. CIBIMA, Fac de Ciencias, Universidad Autónoma UASD, Santo Domingo, Rep. Dominicana.
15 ACHARARIT C, PANYAYONG W, RUCHATAKOMUT E, 1983
Inhibitory action of some Thai herbs. Mahidol Univ Fac Pharm Bangkok, Thailand.
16 BENJAMIN TV, LAMIKANRA A, 1981
Investigation of Cassia alata, a plant used in Nigeria in the treatment of skin diseases. Quart J Crude Drug Res 19(2/3):93-96.
17 CACERES A, LOPEZ BR, GIRON MA, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatophytic infections. 1. Screening for antimycotic activity of 44 plant extracts. J Ethnopharmacol 31(3):263-276.
18 FUZELLIER MC, MORTIER F, LECTARD P, 1982
Activité antifongique de Cassia alata L. Ann Pharm Fr 40(4):357-363.
19 PALANICHAMY S, AMALA BHASKAR E, BAKTHAVATHSALAM R, NAGARAJAN S, 1991
Wound healing activity of Cassia alata. Fitoterapia 62(1):153-156.
20 DAMODARAN S, VENKATARAMAN S, 1994
A study on the therapeutic efficacy of Cassia alata, Linn. Leaf extract against pityriasis versicolor. J Ethnopharmacol 42(1):19-23.
21 MOKKHASMIT M, NGARMWATHANA W, SAWASDIMONGKOL K, PERMPHIPHAT U, 1971
Pharmacological evaluation of Thai medicinal plants (cont.). J Med Assoc Thai 54(7):490-504.
22 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, BARCELO H, LAYNEZ A, FUENTES V, MORON F, 2003
Clases Toxicidad Aguda (CTA) de hoja fresca de Senna alata (L.) Roxb. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
23 MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, FUENTES V, MORON F, 2005
Clases tóxicas agudas tópica de hoja fresca machacada de Senna alata. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
24 LOPEZ M, MARTINEZ MJ, MOREJON Z, BOUCOURT E, FERRADA C, FUENTES V, MORON F, 2005
Irritabilidad dérmica primaria de la maceración acuosa de hoja fresca de Senna alata (L.) Roxb. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Medicina “Dr. Salvador Allende”, La Habana, Cuba.
25 LOGARTO PARRA A, SILVA YHEBRA R, GUERRA SARDINAS I, IGLESIAS BUELA L, 2001
Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
26 MOKKHASMIT M, SWATDIMONGKOL K, SATRAWAHA P, 1971
Study on toxicity of Thai medicinal plants. Bull Dept Med Sci 12(2-4):36-65.
27 VIZOSO A, RAMOS A, VILLAESCUSA A, BETANCOURT J, GARCIA A, PILOTO J, DECALO M, 2002
Passiflora incarnata L. y Senna alata (L.) Roxo: Estudio toxicogenético que emplea 2 sistemas de ensayos a corto plazo. Rev Cubana Plant Med 7(1):27-31.