Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Nicaragua:
- 'kukus
Dominica:
- coco-tree
- coconut tree
San Vicente y las Granadinas:
- coco-tree
- coconut tree
Guatemala:
- cocotero
Honduras:
- cocotero
Santo Domingo:
- cocotero
Distribución geográfica
Originario de las islas del Pacífico, cultivado en las regiones tropicales del mundo.
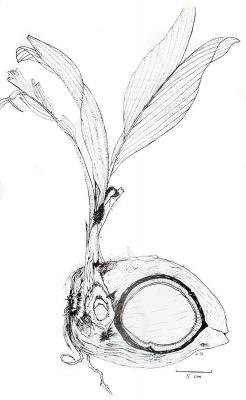
Descripción botánica
Palma de hasta 30 m de altura. Hojas grandes de 3 a 6 m, a veces colgantes, segmentos numerosos, linear-lanceolados de 50 a 70 cm. Flores estaminadas de 1 a 2 cm, blanco-cremosas; las pistiladas de 2.5 cm, pocas en cada inflorescencia. Fruto ovoide, ligeramente tri-anguloso, de 20 a 30 cm, pulpa blanca.
Voucher(s)
Jiménez,1512,JBSD
Girón,270,CFEH
Balland,45,HVB
Farmacopea
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 LAGOS-WITTE S, 1988-89, 1996
Encuesta TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
3 AKER CH, GARMENDIA M, DEVES R, FERNÁNDEZ P, FRITHZ E, HERNÁNDEZ M, SIMEON A, 2003
Encuesta TRAMIL-GEF Bosawas. Departamento de Biologia, Facultad de Ciencias, Universidad Nacional Autónoma de Nicaragua UNAN-León, León, Nicaragua.
4 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
5 GIRÓN L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
6 BALLAND V, GLASGOW A, SPRINGER F, GAYMES G, 2004
TRAMIL survey. enda-caribbean, IICA, UAG & U.PARIS XI, Saint Vincent.
7 MOURA FE JA, BROWN WH, WHITING FM, STULL JW, 1975
Unsaponifiable matter of crude and processed coconut oil. J Sci Food Agr 26(4):523-531.
8 PARIS R, MOYSE H, 1981
Précis de matière médicale. Paris, France: Ed. Maloine.
9 SAITTAGAROON S, KAWAKISHI S, NAMIKI M, 1985
Generation of mannitol from copra meal. J Food Sci 50(3):757-760.
10 TAKEUCHI K, 1961
Amino acids in the endosperm of some Amazonian Palmae. Chiba Daigaku Buurii Gakuba Kiyo Shizen Kagaku 3:321-325.
11 JANSZ BR, JEYARAJ EE, PIERIS N, ABEYRATNE DJ, 1974
Cyanide liberation from linamarin. J Natl Sci Counc Sri Lanka 2:57-65.
12 KINDERLERER JL, KELLARD B, 1987
Alkylpyrazines produced by bacterial spoilage of heat-treated and gamma-irradiated coconut. Chem Ind (London) 16:567-568.
13 MANNAN A, AHMAD K, 1966
Studies on vitamin E in foods of East Pakistan. Pak J Biol Agr Sci 9:13.
14 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p47.
15 CAMBAR P, ALGER J, 1989
Efectos broncopulmonares del aceite de coco en conejos. Informe TRAMIL. Unidad de Farmacología, Facultad de Ciencias Medicas, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
16 BOUCOURT E, MARTÍNEZ M J, MOREJÓN Z, 2010
Evaluación de la actividad antimicrobiana del agua de fruto fresco de Cocos nucifera L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, C. Habana, Cuba.
17 BOUCOURT E, MARTÍNEZ M J, MOREJÓN Z, 2010
Evaluación de la actividad antimicrobiana de la pulpa tierna del fruto fresco de Cocos nucifera L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, C. Habana, Cuba.
18 OLMEDO D, RODRÍGUEZ N, ESPINOSA A, VÁSQUEZ Y, GUPTA MP, 2005
Ensayo antimicrobiano de algunas especies con usos significativos TRAMIL-Centroamérica. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
19 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Velocidad del tránsito intestinal en ratones, del extracto acuoso del fruto fresco de Cocos nucifera. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
20 PAZOS L, COTO T, REYES L, 2007
Antiinflamatorio tópico, en ratones, del aceite del fruto de Cocus nucifera. Informe TRAMIL, Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
21 CÁCERES A, GIRÓN LM, ALVARADO SR, TORRES MF, 1987
Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharmacol 20(3):223-237.
22 VENKATARAMAN S, RAMANUJAN T, VENKATASUBBU V, 1980
Antifungal activity of the alcoholic extract of coconut shell Cocos nucifera L. J Ethnopharmacol 2(3):291-293.
23 JAIN SK, AGRAWAL SC, 1992
Sporostatic effect of some oils against fungi causing otomycosis. Indian J Med Sci 46(1):1-6.
24 CÁCERES A, GIRÓN LM, MARTÍNEZ AM, 1987
Diuretic activity of plants used for the treatments of urinary ailments in Guatemala. J Ethnopharmacol 19(3):233-245.
25 RODRÍGUEZ M, SÁNCHEZ C, 1982
Diuresis del agua de pipa (Cocos nucifera) en ratas. Rev Méd Panamá 7(3):186-19l.
26 KETUSINH O, 1954
Risks associate with intravenous infusion of coconut juice. J Med Ass Thailand 37(5):249-271.
27 MORTON J, 1981
Atlas of medicinal plants of Middle America. Springfield, USA: III: Charles C. Thomas Publisher.
28 BOOTH AN, BICKOFF EM, KOHLER GO, 1960
Estrogen-like activity in vegetable oils and mill by-products. Science 131:1807-1808.
29 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Toxicidad aguda dosis repetida, en ratones, del extracto acuoso del aceite del fruto de Cocos nucifera. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
30 GarcÍa-GONZÁLEZ M, BARBOZA CJ, 2005
Toxicidad aguda (5000 mg/kg) dosis repetida, en ratones, del extracto acuoso (decocción) del fruto fresco de Cocos nucifera. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
31 PAZOS L, COTO T, GONZÁLEZ S, 2006
Toxicidad oral subcrónica, dosis repetida, en ratón, de aceite del fruto fresco de Cocus nucifera. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
32 PAZOS L, COTO T, GONZÁLEZ S, 2006
Irritabilidad dérmica, piel lesionada en conejos, del aceite del fruto puro de Cocus nucifera. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
33 SALERNO JW, SMITH DE, 1991
The use of sesame oil and other vegetable oils in the inhibiting of human colon cancer growth in vitro. Anticancer Res 11(1):209-215.
34 LOCNISKAR M, BELURY MA, CUMBERLAND AG, PATRICK KE, FISCHER SM, 1991
The effect of dietary lipid on skin tumor promotion by benzoyl peroxide, comparison of fish, coconut and corn oil. Carcinogenesis 12(6):1023-1028.
35 BERTON TR, FISCHER SM, CONTI CJ, LOCNISKAR MF, 1996
Comparison of ultraviolet light-induced skin carcinogenesis and ornithine decarboxylase activity in sencar and hairless SKH-1 mice fed a constant level of dietary lipid varying in corn and coconut oil. Nutr Cancer 26(3):353-363.
36 CHINDAVANIG A, 1971
Effect of vegetable oils in plasma cholesterol in man and dog. Master Thesis, Dept. Biochemistry, Mahidol University, Bangkok, Thailand.
37 CARBALLO A, 1995
Cálculo de concentración y dosis de las drogas vegetales TRAMIL: Mensuraciones farmacognósticas y aproximaciones técnico-clínicas. Laboratorio Provincial de Producción de Medicamentos, Sancti Spiritus, Cuba.