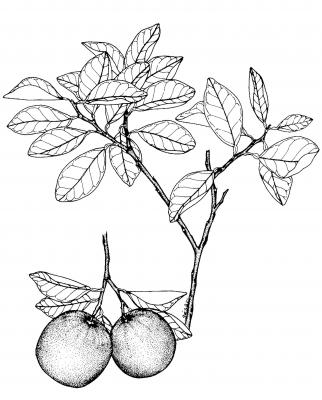
Citrus sinensis
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Santo Domingo:
- naranja dulce (ou china)
Haití:
- zowanj
Distribución geográfica
Nativa de Asia, ampliamente cultivada en regiones tropicales y subtropicales.
Descripción botánica
Árbol de tamaño mediano de hasta 6 m, copa redonda; ramas con espinas delgadas, flexibles, ocasionalmente ausentes. Hojas ampliamente elípticas de 6 a 11 cm de largo con el ápice obtuso o agudo, base cuneada a redondeada. Flores solitarias o en racimos cortos, blancas, aromáticas. Fruto globoso u oval, con 10 a 13 segmentos, pulpa amarillenta, dulce.
Voucher(s)
Veloz,3010,JBSD
Farmacopea
Ed.3References
1 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
2 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
3 TROVATO A, FORESTIERI AM, GALATI EM, TUMINO G, 1984
Influence of the fruit juice of several Citrus species on steroidogenesis in the rat. Plant Med Phytother 18(1):8-14.
4 STEWART I, 1985
Identification of caffeine in Citrus flowers and leaves. J Agric Food Chem 33(6):1163-1165.
5 NICO KJ, CHANDLER BV, 1978
Roots as a probable site for Citrus limonoid biosynthesis. International Citrus Congress, Sydney, Australia. International Society of Citriculture 1:40-42.
6 ABDEL-ALIM MA, ABDEL-HAFEZ OM, EL-KHRISY AM, 1990
The constituents of Citrus sinensis leaves. Fitoterapia 61(5):470-471.
7 SHAFT N, IKRAM M, 1982
Quantitative survey of rutin-containing plants. Part 1. Int J Crude Drug Res 20(4):183-186.
8 EKUNDAYO O, BAKARE O, ADESOMOIU A, STAHL-BISKUP E, 1990
Nigerian sweet orange leaf oil composition. J Essent Oil Res 2(5):199-201.
9 GUANGHAN L, YU W, LEIMING Y, SHUANGLONG H, 1994
Determination of ascorbic acid in fruits and vegetables by stripping voltammetry on a glassy carbon electrode. Food Chem 51(2):237-239.
10 RADFORD T, KAWASHIMA K, FRIEDEL PK, POPE LE, GIANTURCO MA, 1975
Distribution of volatile compounds between the pulp and serum of some fruit juices. J Agric Food Chem 22(6):1066.
11 ROUSEFF RL, SEETHARAMAN K, NAIM M, NAGY S, ZEHAVI U, 1992
Improved HPLC determination of hydroxycinnamic acids in orange juice using solvents containing thf. J Agric Food Chem 40(7):1139-1143.
12 SWATSITANG P, TUCKER G, ROBARDS K, JARDINE D, 2000
Isolation and identification of phenolic compounds in Citrus sinensis. Anal Chim Acta 417(2):231-240.
13 OOGHE WC, OOGHE SJ, DETAVERNIER M, HUYGHEBAERT A, 1995
Characterization of orange juice (Citrus sinensis) by polymethoxylated flavones. J Agric Food Chem 42(10):2191-2195.
14 OOGHE WC, DETAVERNIER CM, 1999
Flavonoids as authenticity markers for Citrus sinensis juice. Fruit Process 9(8):308-313.
15 WIDMER WW, 2000
Determination of naringin and neohesperidin in orange juice by liquid chromatography with UV detection to detect the presence grapefruit juice: collaborative study. J Assoc Offic Anal Chem Int 83(5):1155-1165.
16 GROSS J, CARMON M, LIFSHITZ A, SKLARZ B, 1975
Structural elucidation of some orange juice carotenoids. Phytochemistry 14(1):249-252.
17 PAZOS L, COTO T, REYES L, 2007
Tránsito Intestinal en ratones, del jugo fresco del fruto de Citrus sinensis. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
18 NOGATA Y, YOZA KI, KUSUMOTO KI, KOHYAMA N, SEKIYA K, OHTA H, 1996
Screening for inhibitory activity of Citrus fruit extracts against platelet cyclooxygenase and lipoxygenase. J Agric Food Chem 44(3):725-729.
19 KONOWALCHUK J, SPEIRS JI, 1978
Antiviral effect of commercial juices and beverages. Appl Environ Microbiol 35(6):1219-1220.
20 PÉREZ C, ANESINI C, 1994
In vitro antibacterial activity of Argentine folk medicinal plants against Salmonella typhi. J Ethnopharmacol 44(1):41-46.
21 KAWAKAMI M, SUZUKI K, ISHIZUKA T, HIDAKA T, MATSUKI Y, NAKAMURA H, 1998
Effect of grapefruit juice on pharmacokinetics of itraconazole in healthy subjects. Int J Clin Pharmacol Ther 36(6):306-308.
22 BEZANGER-BEAUQUESNE L, PINKAS M, TORCK M, 1986
Les plantes dans la thérapeutique moderne. 2 éd. Paris, France: Ed. Maloine.
23 HARTMAN JG, LIMBIRD ILE, Eds., 1996
Goodman & Gilman, Las bases farmacológicas de la Terapéutica, 9ª edición. México, México: McGraw-Hill Editores. p1670-1671.
24 PAZOS L, COTO T, CAIZA F, 2008
Toxicidad oral aguda, dosis repetida, en ratón, de hojas frescas de Citrus sinensis. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
25 PAZOS L, COTO T, REYES L, 2007
Irritación ocular, en conejos, del jugo fresco del fruto de Citrus sinensis. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
26 MIYAGI Y, OM AS, CHEE KM, BENNINK MR, 2000
Inhibition of azoxymethane-induced colon cancer by orange juice. Nutr Cancer 36(2):224-229.
27 BALA S, GROVER IS, 1989
Antimutagenicity of some Citrus fruits in Salmonella typhimurium. Mutat Res 222(3):141-148.
28 PORTAL JA, RAMOS A, VIZOSO A, BETANCOURT J, 1995
Estudio genotóxico in vitro de una tintura al 50% de Citrus sinensis (L.) Osbeck. Medi Ciego 1(1):3-6.
29 PORTAL JA, 1995
Evaluación genotóxica in vitro e in vivo de una tintura al 50% de Citrus sinensis (L.) Osbeck (Tesis de Maestría). Universidad Médica de La Habana, La Habana, Cuba.
30 PELLECUER J, 1995
Aromaterapia y toxicidad de los aceites esenciales. Natura Medicatrix 37(8):36-40.
31 CANIGUERAL S, VILA R, RISCO E, PÉREZ F, PORTILLO A, FREIXA B, MILO B, VANACLOCHA B, RÍOS JL, MORÁLES MA, ALONSO JR, BACHILLER LI, PERIS JB, STUBING G, 2002
Citrus sinensis. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Jul.20,2002. URL: www.masson.es/book/fitoterapia.html