Cinnamomum verum
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Haití:
- kannèl
Santo Domingo:
- canela
Dominica:
- ceylon cinnamon
- cinnamon
Martinica:
- kannèl
Guadalupe:
- kannèl
Guayana Francesa:
- kannèl
Distribución geográfica
Originaria de Asia tropical, cultivada en las regiones tropicales.
Descripción botánica
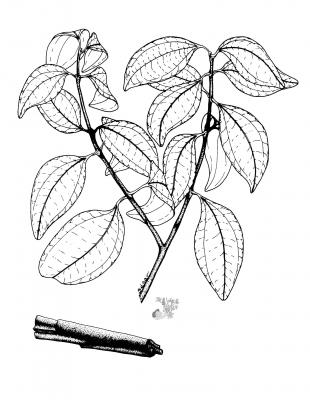
Árbol de 8-15 m, la corteza muy aromática. Hojas opuestas y sub-opuestas, de hasta 15 cm, marcadamente trinervadas desde la base hasta cerca del ápice, brillosas en el haz, glabras, aovadas a elíptico-lanceoladas, redondeadas en la base. Flores blanco-amarillentas en panículas laxas. Frutos de 1.7 cm con punta.
Voucher(s)
Slane,528,SLNH
Jiménez,1509,JBSD
Farmacopea
Ed.3References
1 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
2 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
3 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
4 LEUNG A, 1980
Encyclopedia of common natural ingredients used in food, drugs and cosmetics. Hoboken, USA: Wiley Interscience Publication.
5 NAMBA T, KIKUCHI T, MIKAGE M, KADOTA S, KOMATZU K, SHMIZU M, TOMIMORI T, 1987
Studies on the natural medicinal resources from Sri Lanka (1). On anatomical and chemical differences among each grade of Cinnamomi veri cortex. Shoyakugaku Zasshi 41(1):35-42.
6 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p44.
7 RAJ RK, 1975
Screening of indigenous plants for antihelmintic action against human Ascaris lumbricoides: Part II. Indian J Physiol Pharmacol 19(1):47-49.
8 ATTA AH, ALKOFAHI A, 1998
Anti-nociceptive and antiinflammatory effects of some Jordanian medicinal plant extracts. J Ethnopharmacol 60(2):117-124.
9 SHARMA A, GHANEKAR AS, PADWAL-DESAI SR, NADKARNI GB, 1984
Microbiological status and antifungal properties of irradiated spices. J Agric Food Chem 32(5):1061-1063.
10 GEORGE M, PETALAI K, 1949
Investigations on plant antibiotics. Part IV. Further search for antibiotic substances in Indian medicinal plants. Indian J Med Res 37:169-181.
11 NAMBA T, SAWA K, GEWALI MB, HATTORI M, NARUSE Y, KAGAMIMORI S, 1989
Studies on development of immunomodulating drugs (II). Effect of Ayurvedic medicines on blastogenesis of lymphocytes from mice. Shoyakugaku Zasshi 43(3):250-255.
12 KIUCHI F, NAKAMURA N, MIYASHITA N, NISHIZAWA S, TSUDA Y, KONDO K, 1989
Nematocidal activity of some anthelmintic traditional medicines and spices by a new assay method using larvae of Toxocara canis. Shoyakugaku Zasshi 43(4):279-287.
13 SUGAYA E, ISHIGE A, SEKIGUCHI K, IIZUKA S, SUGIMOTO A, YUZURIHARA M, HOSOYA E, 1988
Inhibitory effect of a mixture of herbal drugs TJ-960 (SK) on pentylenetetrazol-induced convulsions in mice. Epilepsy Res 2(5):337-339.
14 SUGAYA E, ISHIGE A, SEKIGUCHI K, IIZUKA S, ITO K, SUGIMOTO A, ABURANDA M, HOSOYA E, 1988
Inhibitory effect of TJ-960 (SK) on pentylenetetrazol-induced EEG power spectrum changes. Epilepsy Res 2(1):27-31.
15 RAHARIVELOMANANA PJ, TERROM GP, BIANCHINI JP, COULANGES P, 1989
Study of the antimicrobial action of various essential oil extracts from Madagascar plants. II. The Lauraceae. Arch Inst Pasteur Madagascar 56(1):261-271.
16 REITER M, BRANDT W, 1985
Relaxant effects of terpenoid on tracheal and ileal smooth muscles of the guinea pig. Arzneim-Forsch 35(1):408-414.
17 SUGAYA E, TSUDA T, SUGAYA E, USAMI M, TAKAMURA K, 1979
Local anaesthetic action of the Chinese medicine Saiko-Keishi-To. Planta Med 37:274-276.
18 HARRIES N, JAMES KC, PUGH WK, 1978
Antifoaming and carminative actions of volatile oil. J Clin Pharmacol 2:171-177.
19 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Toxicidad aguda dosis repetida, en ratones, del extracto acuoso (decocción) de las astillas de Cinnamomum verum . Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
20 SIVASWAMY SN, BALACHANDRAN B, BALANEHRU S, SIVARAMAKRISHNAN VM, 1991
Mutagenic activity of south Indian food items. Indian J Exp Biol 29(8):730-737.
21 UNGSURUNGSIE M, SUTHIENKUL O, PAOVALO C, 1982
Mutagenicity screening of popular Thai species. Food Chem Toxicol 20(5):527-530.
22 SHAH AH, AL-SHARCEF AH, AGEEL AM, QURESHI S, 1998
Toxicity studies on mice of common species: Cinnamomum zeylanicum bark and Piper longum fruits. Plant Foods Hum Nutr 52(3):231-239.
23 SÁNCHEZ-PALOMERA E, 1951
Concept of the mucous barrier and its significance. Gastroenterology 18:269-286.
24 NIR Y, POTASMAN I, STERMER E, TABAK M, NEEMAN I, 2005
Controlled trial of the effect of cinnamon extract on Helicobacter pylori. Helicobacter 5(2):94-97.
25 NATURAL STANDARD MONOGRAPH 2007
Cinnamon (Cinnamomum spp.). www.naturalstandard.com (12jan2012)
26 SEETHARAM K, PASRICHA J, 1987
Condiments and contact dermatitis of the finger-tips. Indian J Dermatol Venereol Leprol 53(6):325-328.
27 STAGER J, WUTHRICH B, JOHANSSON S, 1991
Spice allergy in celery-sensitive patients. Allergy 46(6):475-478.
28 World Health Organization, 1999
Cortex Cinnamomi. WHO monographs on selected medicinal plants. Vol. I.
Geneva, Switzerland: WHO. pp95-104.