Capsicum annuum
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Santo Domingo:
- ají caribe
San Vicente y las Granadinas:
- pepper bush
Haití:
- piman caraïbe
- piman zwézo
Distribución geográfica
Originaria de América tropical. Cultivada en zonas tropicales y templadas.
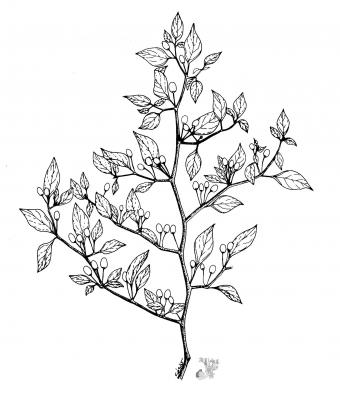
Descripción botánica
Hierba o arbusto densamente ramificado. Hojas con pecíolo delgado, solitarias o en pares, ovadas u ovado-lanceoladas, ápice acuminado. Dos flores o más en cada nudo, rara vez una; cáliz truncado o con lóbulos diminutos; corola blanco-verdosa o blanco amarillenta. Fruto rojo, de 1.5 a 3 cm de diámetro, elipsoide-lanceolado o lanceolado, con ápice agudo. Semillas cremosas a amarillentas.
Especie muy elastica con una gran cantidad de cultivares que poseen una gran diversidad de forma en sus frutos.
Voucher(s)
Jiménez,17,JBSD
Balland,033,JBSD
Farmacopea
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
3 BALLAND V, GLASGOW A, SPRINGER F, GAYMES G, 2004
TRAMIL survey. enda-caribbean, IICA, UAG & U.PARIS XI, Saint Vincent.
4 GUTSU EV, KINTYA PK, LAZURIIEVSKII GV, Balashova nn, 1984
Steroid alkaloids and glycosides of Capsicum annuum L. Rast Resur 20(1):127-130.
5 POLITIS J, 1948
Distribution of chlorogenic acid in solanaceae and in the organs of these plants. Compt Rend 226:692-693.
6 TOMAS F, FERRERES F, 1980
Flavonoids from the leaves of Capsicum annuum (Solanaceae). I. Major components. Afinidad 37:517-518.
7 NOWACZYK L, 2011
Technlogical characteristics of fruit as an average of fruit as an average of soft-flesh Capsicum spp genotypes. Herba Polonica 57(2):38-44.
8 MARTÍNEZ MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, FUENTES V, MORÓN F, 2005
Antimicrobial effect of fresh leaves and their juice of Capsicum annuum. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
9 CICHEWICZ RH, THORPE PA, 1996
The antimicrobial properties of chili peppers (Capsicum species) and their uses in Mayan medicine. J Ethnopharmacol 52(2):61-70.
10 DUKE JA, 1992
Handbook of biologically active phytochemicals and their activities. Boca Raton, USA: CRC Press.
11 DUKE JA, 2000
Chemicals and their biological activities in: Capsicum annuum L. Dr. Duke’s Phytochemical and Ethnobotanical Databases. USDA-ARS-NGRL, Beltsville Agricultural Research Center, Beltsville, USA, Aug.10,2000. URL: http://www.ars-grin.gov/cgi-bin/duke/farmacy2.pl
12 MARTÍNEZ MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, FUENTES V, MORÓN F, 2005
Irritabilidad dérmica primaria de hoja fresca en aceite de Capsicum annuum. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
13 MARTÍNEZ MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, FUENTES V, MORÓN F, 2005
Clases tóxicas agudas tópica de hoja fresca machacada de Capsicum annuum. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
14 DHAWAN BN, PATNAIK GK, RASTOGI RP, SINGH KK, TANDON JS, 1977
Screening of Indian plants for biological activity VI. Indian J Exp Biol 15(3):208-219.
15 GUZZO CA, LAZARUS GS, WERTH VP, 1996
Dermatological pharmacology. In: HARDMAN JG, GILMAN AG, LIMBIRD LE Eds. Goodman and Gilman’s the pharmacological basis of therapeutics. 9th ed. New York, USA: The McGraw-Hill Professional Publishing, International Edition.
16 PEISKER V, ARANGUREN ML, MONTERO DE ESPINOSA E, MORAES J, LEAL MS, SANZ J, 1995
Vademécum Internacional. Madrid, España: Medicom S.A.
17 CARBALLO A, 1995
Cálculo de concentración y dosis de las drogas vegetales TRAMIL: Mensuraciones farmacognósticas y aproximaciones técnico-clínicas. Laboratorio provincial de producción de medicamentos, Sancti Spiritus, Cuba.