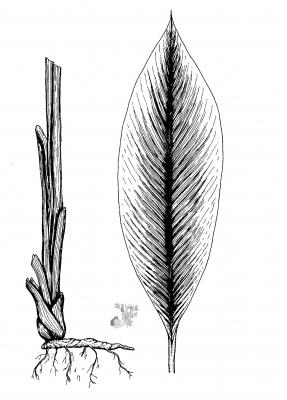
Curcuma longa
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Haití:
- curcuma
- safran
Santa Lucía:
- indian saffron
- tjitjima
- turmeric
Distribución geográfica
Originaria de Asia tropical, pantropical debido al cultivo.
Descripción botánica
Herbácea acaulescente, de 60 a 90 cm. Tubérculos gruesos, cilíndricos o elipsoideos, amarillos por dentro. Hojas oblongas o elípticas, de 30 a 50 cm, acuminadas. Espigas cilíndricas de 10 a 20 cm, sobre un escapo de 12 cm; brácteas verde pálido, las superiores rosaditas; flores amarillo pálido.
Voucher(s)
Jiménez,685,JBSD
Farmacopea
Ed.3References
1 JEAN-PIERRE L, 1988
TRAMIL survey. St. Lucia National Herbarium, Castries, St. Lucia.
2 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
3 OGBEIDE ON, EDUAVEGUAVOEN OI, PARVEZ M, 1985
Identification of 2-(hydroxymethyl) anthraquinone in Curcuma domestica. Pak J Sci 37(1/4):15-17.
4 SU HCF, HORVAT R, JILANI G, 1982
Isolation, purification, and characterization of insect repellents from Curcuma longa L. J Agric Food Chem 30:290-292.
5 OHSHIRO M, KUROYANAGI M, UENO A, 1990
Structures of sesquiterpenes from Curcuma longa. Phytochemistry 29(7):2201-2205.
6 CHEN YH, YU JG, FANG HJ, 1983
Studies on Chinese Curcuma. III. Comparison of the volatile oil and phenolic constituents from the rhizome and the tuber of Cucurma longa. Chung Yao T'ung Pao 8(1):27-29.
7 MOON CK, PARK NS, KOH SK, 1976
Studies on the lipid components of Curcuma longa. I. The composition of fatty acids and sterols. Soul Taehakkyo Yakhak Nonmunjip 1:132.
8 YASUDA K, TSUDA T, SHIMIZU H, SUGAYA A, 1988
Multiplication of Curcuma species by tissue culture. Planta Med 54(1):75-79.
9 SCHULTZ JM, HERRMANN K, 1980
Occurrence of hydroxybenzoic acids and hydroxycinnamic acid in spices. IV. Phenolics of spices. Z Lebensm-Unters Forsch 171:193-199.
10 PARK SN, BOO YC, 1991
Cell protection from damage by active oxygen with curcuminoids. Patent-Fr Demande-2,655,054.
11 TODA S, MIYASE T, ARICHI H, TANIZAWA H, TAKINO Y, 1985
Natural antioxidants. III. Antioxidative components isolated from rhizome of Curcuma longa L. Chem Pharm Bull 33(4):1725-1728.
12 JENTZSCH K, SPIEGL P, KAMITZ R, 1970
Qualitative and quantitative studies of curcuma dyes in different Zingiberaceae drugs. 2. Quantitative studies. Sci Pharm 38(1):50-58.
13 KARIG F, 1975
Rapid identification of curcuma rhizomes with the tas (thermomicroseparation and application) process. Dtsch Apoth Ztg 115(10):325-328.
14 GONDA R, TOMODA M, TAKADA K, OHARA N, SHIMIZU N, 1992
The core structure of ukonan A, a phagocytosis-activating polysaccharide from the rhizome of Curcuma longa, and immunological activities of degradation products. Chem Pharm Bull 40(4):990-993.
15 WOO WS, CHI HJ, YUN HS, WOO LK, 1977
Phytochemical screening of Korean medicinal plants (II). Korean J Pharmacog 8:103-108.
16 DE SOUSA M, MATOS ME, MATOS FJ, MACHADO MI, CRAVEIRO AA, 1991
Constituintes químicos ativos de plantas medicinais Brasileiras. Laboratorio de produtos naturais, Fortaleza, Brasil: Ceará Edições UFC.
17 YANG M, DONG X, TANG Y, 1984
Studies of the chemical constituents of common turmeric (Curcuma longa). Chung Ts'ao Yao 15(5):197-198.
18 ZHAO DY, YANG MK, 1986
Separation and determination of cucurminoids in Curcuma longa L. and its preparation by HPLC. Yao Hsueh Pao 21(5):382-385.
19 KISO Y, SUZUKI Y, WATANABE N, OSHIMA Y, HIKINO H, 1983
Antihepatotoxic principles of Curcuma longa rhizomes. Planta Med 49(3):185-187.
20 GONDA R, TOMODA M, SHIMIZU N, KANARI M, 1990
Characterization of polysaccharides having activity on the reticuloendothelial system from the rhizome of Curcuma longa. Chem Pharm Bull Tokyo 38(2):482-486.
21 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p56.
22 SOLÍS PN, RODRÍGUEZ N, ESPINOSA A, GUPTA MP, 2004
Estudio antimicrobiano de algunas plantas TRAMIL con usos en Martinica. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
23 JOYEUX M, FLEURENTIN J, DORFMAN P, MONTIER F, 1988
Recherche d'une activité hépatotrope et antiradicalaire de plantes médicinales de la caraïbe. Rapport TRAMIL. Laboratoire de pharmacognosie, Centre des Sciences pour l'Environnement, Metz, France.
24 CHANG IM, WOO WS, 1980
Screening of Korean medicinal plants for antitumor activity. Arch Pharm Res 3(2):75-78.
25 KOSUGE T, YOKOTA M, SUGIYAMA K, YAMAMOTO T, NI MY, YAN SC, 1985
Studies of antitumor activities and antitumor principles of Chinese herbs. Yakugaku Zasshi 105(8):791-795.
26 ITOKAWA H, 1988
Research on antineoplastic drugs from natural sources, especially from higher plants. Yakugaku Zasshi 108(9):824-841.
27 WHO, 2002
WHO monographs on selected medicinal plants. Volume 1. www.who.int/medicines/library/trm/medicinalplants/pdf/259to266.pdf (28Feb2003).
28 DONATUS IA, SARDJOKO, VERMEULEN NPE, 1990
Cytotoxic and cytoprotective activities of curcumin. Effects on paracetamol induced cytotoxicity, lipid peroxidation and glutathione depletion in rat hepatocytes. Biochem Pharmacol 39(12):1869-1875.
29 PAZOS L, COTO T, GONZÁLEZ S, 2006
Toxicidad oral subcrónica, dosis repetida, en ratón, del extracto de rizoma fresco de Curcuma longa. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
30 DESHPANDE SS, LALITHA VS, INGLE AD, RASTE AS, GADRE SG, MARU GB, 1998
Subchronic oral toxicity of turmeric and ethanolic turmeric extract in female mice and rats. Toxicol Lett 95(3):183-193.
31 POLASA K, SESIKARAN B, KRISHNA TP, KRISHNASWAMY K, 1991
Turmeric (Curcuma longa) - induced reduction in urinary mutagens. Food Chem Toxicol 29(10):699-706.
32 CHAVALITTUMRONG P, CHIVAPAT S, RATTANAJARASROJ S, PUNYAMONG S, CHUTHAPUTTI A, PHISALAPHONG C, 2002
Chronic toxicity study of curcuminoids in rats. Songklanakarin J Sci Technol 24(4):633-647.
33 YEGNANARAYANA M, SARAF AP, BALWANI JH, 1976
Comparison of anti-inflammatory effect of various extracts of Curcuma longa. Indian J Med Res 64(4):601-608.
34 GILANI AH, SHAH AJ, GHAYUR MN, MAJEED GK, 2005
Pharmacological basis for the use of turmeric in gastrointestinal and respiratory disorders. Life Sciences 76(26):3089-3105.
35 QURESHI S, SHAH AH, AGEEL AM, 1992
Toxicity studies on Alpinia galanga and Curcuma longa. Planta Med 58(2):124-127.
36 MIQUEL J, MARTÍNEZ M, DIEZ A, DE JUAN E, SOLER A, RAMÍREZ A, LABORDA J, CARRISON M, 1995
Effects of turmeric on blood and liver lipoperoxide levels of mice: lack of toxicity. Age(Chester Pa) 18(4):171-174.
37 SEETHARAM KA, PASRICHA JS, 1987
Condiments and contact dermatitis of the finger-tips. Indian J Dermatol Venereol Leprol 53(6):325-328.
38 ALBORNOZ A, 1993
Medicina Tradicional Herbaria. Caracas, Venezuela: Editorial Instituto Farmacoterápico Latino S.A. p227.