Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Mexique:
- aguacate
Guatemala:
- aguacate
République dominicaine:
- aguacate
Barbade:
- pear tree
Martinique:
- zaboka
Distribution géographique
Originaire d’Amérique tropicale, cultivée dans les zones tropicales et subtropicales.
Description botanique
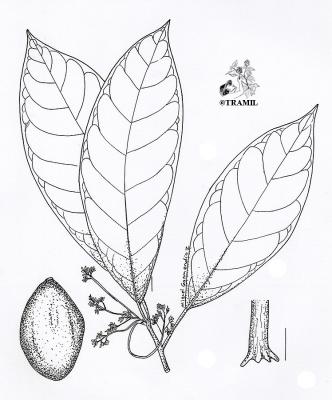
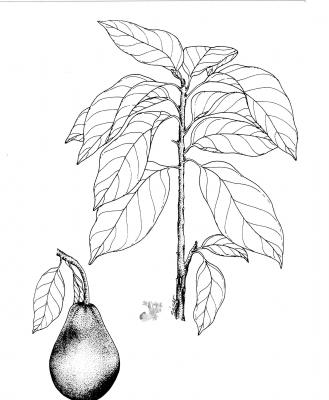
Arbre fruitier pouvant atteindre 20 m, tête dense, arrondie ou allongée. Feuilles alternes, elliptiques à obovales, aiguës ou acuminées à la pointe, cunéiformes à arrondies à la base, penninervées. Panicules plus courtes que les feuilles, subterminales; fleurs parfaites, vert-jaunâtres; lobes du calice pubescents sur les deux surfaces. Fruit très variable, drupe généralement ovale, écorce verte, pulpe molle renfermant une seule grande graine.
Voucher(s)
Faujour,6,BAR
Girón,245,CFEH
Longuefosse&Nossin,25,HAVPM
Medina,60,CICY
Pharmacopée
Ed.3References
1 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
3 FAUJOUR A, MURREY D, CHELTENHAM-CORBIN B, CARRINGTON S, 2003
TRAMIL survey. enda-caribbean, IICA & UAG, Saint Thomas, Barbados.
4 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
5 MENDEZ M, MEDINA ML, DURAN R, 1996
Encuesta TRAMIL. Unidad de recursos naturales, Centro de Investigación Científica de Yucatán CICY, Mérida, México.
6 CANIGUERAL S, VILA R, RISCO E, PEREZ F, PORTILLO A, FREIXA B, MILO B, VANACLOCHA B, RIOS JL, MORALES MA, ALONSO JR, BACHILLER LI, PERIS JB, STUBING G, 2002
Persea americana. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Feb. 26, 2003. URL: www.masson.es/book/fitoterapia.html
7 BERGH BO, SCORA RW, STOREY WB, 1973
Comparison of leaf terpenes in Persea subgenus persea. Bot Gaz (Chicago) 134(2)130-134.
8 KING JR, KNIGHT RJ, 1992
Volatile components of the leaves of various avocado cultivars. J Agric Food Chem 40(7):1182-1185.
9 DE ALMEIDA AP, MIRANDA MMFS, SIMONI IC, WIGG MD, LAGROTA MHC, COSTA SS, 1998
Flavonol monoglycosides isolated from the antiviral fractions of Persea americana (Lauraceae) leaf infusion. Phytother Res 12(8):562-567.
10 MERIÇLI F, MERIÇLI AH, YILMAZ F, YÜNCÜLER G, YÜNCÜLER O, 1992
Flavonoids of avocado (Persea americana) leaves. Acta Pharm Turc 34(2):61-63.
11 BATE-SMITH EC, 1975
Phytochemistry of proanthocyanidins. Phytochemistry 14(4):1107-1113.
12 MURAKOSHI S, ISOGAI A, CHANG CF, KAMIKADO T, SAKURAI A, TAMURA S, 1976
The effects of two components from avocado leaves (Persea americana) and related compounds on the growth of silkworm larvae, Bombyx mori. Nippon Oyo Dobutsu Konchu Gakkaishi 20:87-91.
13 CACERES A, GONZALEZ S, GIRON L, 1998
Demostración de la actividad antimicrobiana de plantas TRAMIL en base a los usos populares en la cuenca del Caribe. Informe TRAMIL. Laboratorio de productos fitofarmacéuticos Farmaya y Facultad de ciencias químicas y farmacia, Universidad de San Carlos, Guatemala, Guatemala.
14 HERRERA J, 1986
Determinación de actividades biológicas de vegetales utilizados en medicina tradicional. Informe TRAMIL. Dep. de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
15 GARCIA GM, COTO MT, GONZALEZ CS, PAZOS L, 1999
Actividad bronquial del extracto acuoso de hoja fresca de Persea americana. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
16 PAZOS L, COTO T, GONZALEZ S, QUIROS S, 2003
Tránsito intestinal, en ratones, del extracto acuoso de hojas frescas de Persea americana. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
17 MORON FJ, GARCIA AI, VICTORIA MC, MOREJON Z, LOPEZ M, BACALLAO Y, FUENTES V, 2008
Acción analgésica de la decocción de hojas frescas de Persea americana Mill. (aguacate) en ratones. Trabajo TRAMIL. Laboratorio Central de Farmacología, Facultad de Medicina “Dr. Salvador Allende”, La Habana, Cuba.
18 ADEYEMI OO, OKPO SO, OGUNTI OO, 2002
Analgesic and anti-inflammatory effects of the aqueous extract of leaves of Persea americana Mill Lauraceae. Fitoterapia 73(5):375-380.
19 HERRERA J, 1988
Determinación de actividades biológicas de vegetales utilizados en medicina tradicional. Informe TRAMIL. Laboratorio de fitofarmacología, Dep. de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
20 GARCIA GM, COTO MT, GONZALEZ CS, PAZOS L, 2000
Toxicidad aguda en ratones, del extracto acuoso de hojas frescas de Persea americana. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
21 LOPEZ M, MARTINEZ MJ, MOREJON Z, BOUCOURT E, FUENTES V, MORON F. 2005
Irritabilidad dérmica primaria de hoja fresca machacada de Persea americana Mill. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Medicina “Dr. Salvador Allende”, La Habana, Cuba.
22 CRAIGMILL AL, SEAWRIGHT AA, MATTILA T, FROST AJ, 1989
Pathological changes in the mammary gland and biochemical changes in milk of the goat following oral dosing with leaf of the avocado (Persea americana). Aust Vet J 66(7):206-211.
23 GRANT R, BASSON PA, BOOKER HH, HOFHERR JB, ANTHONISSEN M, 1991
Cardiomyopathy caused by avocado (Persea americana Mill.) leaves. J S Afr Vet Assoc 62(1):21-22.