Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Martinique:
- goyav
- gwayav
Guadeloupe:
- goyav
- goyav
- gwayav
- gwayav
Dominique:
- goyav
- gwayav
Haïti:
- goyav
- gwayav
Trinité-et-Tobago:
- guava
Grenade:
- guava
République dominicaine:
- guayaba
Vénézuéla:
- guayaba
Colombie:
- guayaba
Guatemala:
- guayaba
Panama:
- guayaba
Mexique:
- guayaba
Honduras:
- guayabo
Autres noms vernaculaires
Haïti:
- Goyav
- Goyav/guayaba
- Gwayav
Guadeloupe:
- goyave
- Goyave
- Goyavier (gwayav)
- Gwoyav
Guyane:
- Goyave
- Kwiyau
Colombie:
- Guava
- Guava
- Guayaba
Trinité-et-Tobago:
- Guava
Dominique:
- Guava
- Guava o Gureva
Nicaragua:
- Guayaba
République dominicaine:
- Guayaba
Vénézuéla:
- Guayaba
Cuba:
- Guayaba
Honduras:
- Guayaba
- Guayaba roja
- Guayabo
Mexique:
- Guayaba / pichi'
Martinique:
- gwayav, goyavier
Distribution géographique
Originaire d’Amérique tropicale, naturalisée dans les régions tropicales et subtropicales de l’Ancien Monde.
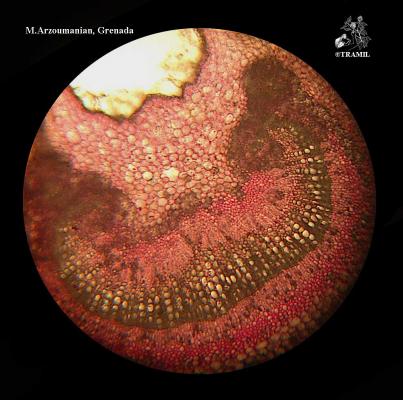
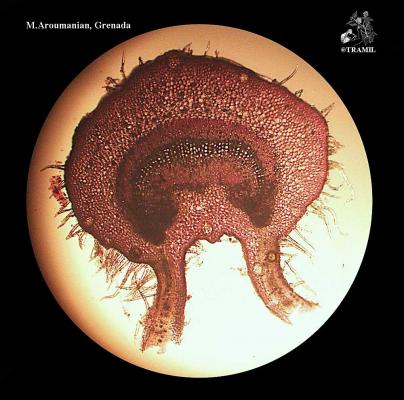
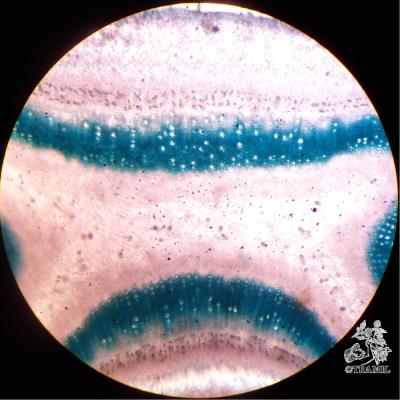
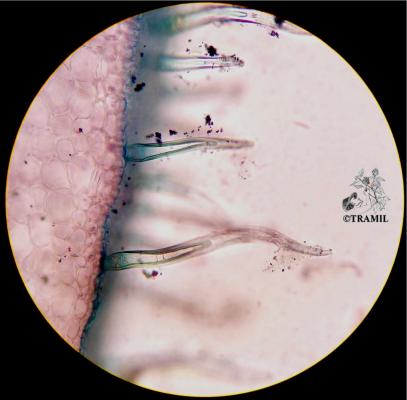
Description botanique
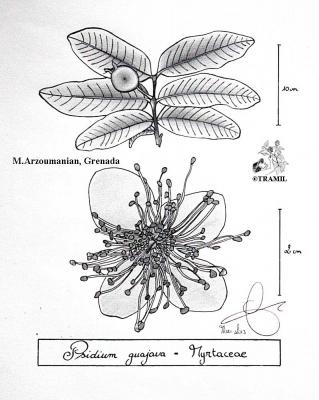
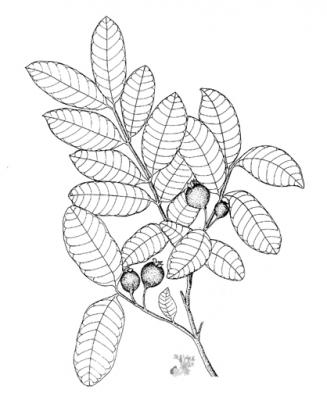
Arbre ou arbuste pouvant atteindre 10 m de haut, écorce squameuse. Feuilles opposées à court pétiole, elliptiques à oblongues, subcoriaces, avec nervures visiblement imprimées sur la partie supérieure, proéminentes sur l’inférieure. Fleurs blanches, solitaires ou en groupes de 2 à 3, sur fins pédoncules; nombreuses étamines. Fruit comestible, arrondi ou piriforme, jaune, de 3 à 6 cm de diamètre.
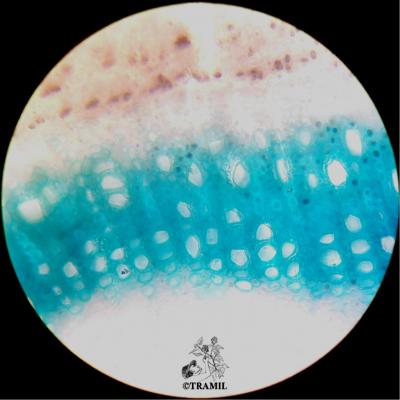
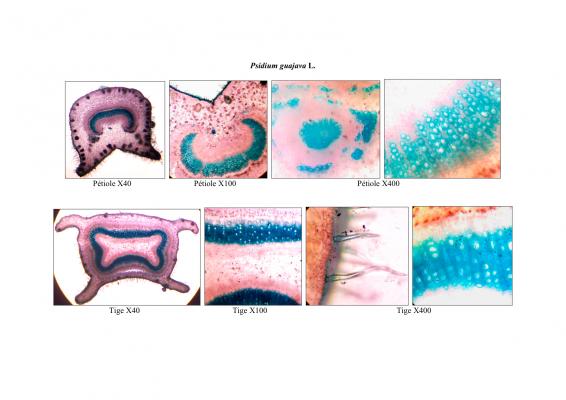
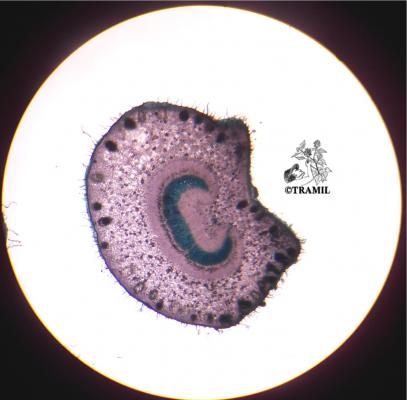
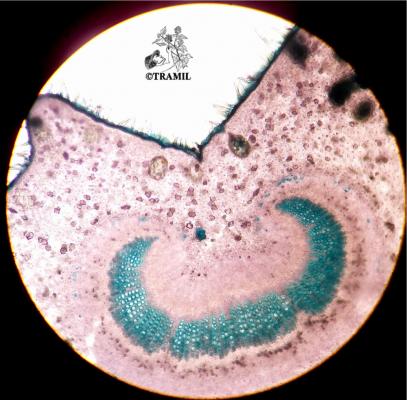
Voucher(s)
Delens,23,VEN
Gimenez,275705-33,VEN
Girón,267,CFEH
Jiménez,41,JBSD
Medina,41,CICY
Longuefosse&Nossin,32, HAVPMC
Pinzón,21898,CUVC
Espinosa,6178,FLORPAN
Delaigue,24,NHTT
Soto,45862,CR
Fuentes,4754,ROIG
Boulogne,TH,16,UAG/TB,14,UAG
Pharmacopée
Ed.3References
1 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 HERRERA J, 1994
Encuesta TRAMIL (Costa atlántica). Laboratorio de fitofarmacología, Departamento de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
3 EDOUARD JA, 1992
Enquête TRAMIL. Lycée agricole, Baie-Mahault, Guadeloupe.
4 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
5 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
6 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
7 DELENS M, 1990-92
Encuesta TRAMIL. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
8 DELAIGUE J, 2005
TRAMIL survey. PRDI, Tobago House of Assembly, Scarborough, Tobago.
9 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
10 SOLLS PN, ESPINOSA A, DE GRACIA J, MARTINEZ L, GUPTA MP, 2003
Encuesta TRAMIL (Emberá-Wounaann). Centro de Investigaciones Farmacognósticas de la Flora Panameña, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
11 BALZ E, BOYER A, BURAUD M, 2007
Enquête TRAMIL à Marie-Galante. U. Bordeaux 3, U. Paris XI Chatenay-Malabry, UAG, Guadeloupe.
12 BOYER A, BURAUD M, 2007
Enquête TRAMIL à La Désirade. U. Paris XI Chatenay-Malabry, UAG, Guadeloupe.
13 BOULOGNE I, 2009
Enquête TRAMIL, (Terre-de-Bas et Terre-de-Haut) Les Saintes, UAG, Guadeloupe (FWI).
14 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
15 MARCELLE G, 1996
TRAMIL survey. Produce chemist laboratory, Ministry of Agriculture, St George's, Grenada.
16 MARTINEZ M, HERNANDEZ O, HERNANDEZ J, SARMIENTO E, 2003
Encuesta TRAMIL Guajiquiro, La Paz. Laboratorio de Histolología Vegetal y Etnobotánica, Dep. de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
17 MARTINEZ M, MEDINA D, SUANSIN G, SARMIENTO E, 2003
Encuesta TRAMIL Las Marías, Gracias a Dios. Laboratorio de Histolología Vegetal y Etnobotánica, Dep. de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
18 HENDERSON C, KRISHNARAYAN V, CASTILLO J, 1996
TRAMIL survey. Belize Enterprise for Sustainable Technology BEST, Belmopan, Belize.
19 MOREJON Z, LOPEZ M, GARCIA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORON F, BOULOGNE I, ROBINEAU L, 2009
Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Cuba.
20 MENDEZ M, MEDINA ML, DURAN R, 1996
Encuesta TRAMIL. Unidad de recursos naturales, Centro de Investigación Científica de Yucatán CICY, Mérida, México.
21 Solis PN, Olmedo D, Buitrago de Tello RE, Gupta MP, 2000
Estudio fitoquímico y toxicológico de algunas plantas TRAMIL. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
22 WILSON CW, SHAW PE, 1978
Terpene hydrocarbons from Psidium guajava. Phytochemistry 17:1435-1436.
23 MACLEOD AJ, DE TROCONIS NG, 1982
Volatile flavour components of guava. Phytochemistry 21(6):1339-1342.
24 MISRA K, SESHADRI TR, 1968
Chemical components of the fruits of Psidium guajava. Phytochemistry 7(4):641-645.
25 CHIANG H, LEE S, GUO S, 1986
Active principles of hypoglycemic effect from Psidium guajava. Part II. Asian J Pharm Suppl 6(8):58.
26 VARSHNEY I, BADHWAR G, KHAN A, SHRIVASTAVA A, 1971
Saponins and sapogenins of Sesbania grandiflora seeds, Albizzia lebbek pods and Psidium guajava fruits. Indian J Appl Chem 34(5):214-216.
27 BASSOLS F, DEMOLE EP, 1994
The occurrence of pentane-2-thiol in guava fruit. J Essent Oil Res 6(5):481-483.
28 LOWRY JB, 1968
The distribution and potential taxonomic value of alkylated ellagic acids. Phytochemistry 7(10):1803-1813.
29 DAVIS P, MUNROE K, SELHIME A, 1976
Laboratory Proc Fla State Hort Soc bioassay of volatile naturally occurring compounds against the Caribbean fruit fly. p174.
30 MAIR AGR, PANDIYAN M, VENKASUBRAMANIAN H, 1987
Polyphenolic compounds from flowers of Psidium guajava. Fitoterapia 58(3):204-205.
31 SESHADRI TR, VASISHTA K, 1965
Polyphenols of the leaves of Psidium guava-quercetin, guaijaverin, leucocyanidin and amritoside. Phytochemistry 4(6):989-992.
32 GRIFFITHS LA, 1959
On the distribution of gentisic acid in green plants. J Exp Biol 10(3):437-442.
33 KAKIUCHI N, HATTORI M, NAMBA T, NISHIZAWA M, YAMAGISHI T, OKUDA T, 1985
Inhibitory effect of tannins on reverse transcriptase from RNA tumor virus. J Nat Prod 48(4):614-621.
34 LOZOYA X, MECKES M, ABOU-AAID M, TORTORIELLO J, NOZZOLILLO C, ARNASON J, 1994
Quercetin glycosides in Psidium guajava L. leaves and determination of a spasmolytic principle. Arch Med Res 25(1):11-15.
35 OKUDA T, HATANO T, YAZAKI K, 1984
Guavin B, an ellagitannin of novel type. Chem Pharm Bull 32(9):3787-3788.
36 LUTTERODT GD, 1989
Inhibition of gastrointestinal release of acetylcholine by quercetin as a possible mode of action of Psidium guajava leaf extracts in the treatment of acute diarrhoeal disease. J Ethnopharmacol 25(3):235-247.
37 OKUDA T, YOSHIDA T, HATANO T, YAZAKI K, ASHIDA M, 1982
Tannins and related compounds in Myrtaceae. Ellagitannins of the Casuarinaceae, Stachyuraceae and Myrtaceae. Phytochemistry 21:2871-2874.
38 OKUDA T, YOSHIDA T, HATANO T, YAZAKI K, IKEGAMI Y, SHINGU T, 1987
Guavins A, C and D, complex tannins from Psidium guajava. Chem Pharm Bull 35(1):443-446.
39 OSMAN AM, YOUNES ME, SHETA AE, 1974
Triterpenoids of the leaves of Psidium guajava. Phytochemistry 13(9):2015-2016.
40 OSMAN A, EL-GARBY Y, SHETA A, 1975
Chemical examination of local plants part. VII. Psidium guajava leaf extracts. Egypt J Chem 18:347.
41 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p136.
42 ECHEMENDIA C, MORON F, 1997
Efecto antidiarreico de la tintura al 20% de hojas de Psidium guajava (guayaba), en pacientes con diarrea aguda simple en atención primaria de salud. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
43 ECHEMENDIA C, 1997
Efecto antidiarreico de la tintura al 20% de hojas de Psidium guajava (guayaba), en pacientes con diarrea aguda simple en atención primaria de salud (Tesis de Maestría). Universidad Médica de La Habana, Cuba.
44 GUPTA M, ESPOSITO AVELLA M, 1988
Evaluación química y farmacológica de algunas plantas medicinales de TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
45 MORON F, MARTINEZ MC, MORON D, 1999
Disminución del tránsito intestinal en ratones por tintura de guayaba (Psidium guajava L.) oral. Rev Cubana Planta Med 4(2):54-56.
46 PAZOS L, QUIROS S, GONZALEZ S, 2006
Transito intestinal, en ratón, del extracto de la corteza fresca de Psidium guajava. Trabajo TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
47 WEI-WEI ZHANG, YAN LI, XUE-QING WANG, FENG TIAN, HONG CAO, MIN-WEI WANG, QI-SHI SUN, 2005
Effects of magnolol and honokiol derived from traditional Chinese herbal remedies on gastrointestinal movement. World J Gastroenterol 11(28):4414-4418.
48 MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BOUCOURT E, MORON F, 2000
Actividad antimicrobiana in vitro de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
49 BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010
Evaluación de la actividad antimicrobiana del extracto acuoso de la corteza del tallo fresco Psidium guajava L.Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
50 BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010
Evaluación de la actividad antimicrobiana del extracto acuoso de la hojas frescas Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
51 BIRDI T, DASWANI P, BRIJESH S, TETALI P, NATU A, ANTIA1 N, 2010
Newer insights into the mechanism of action of Psidium guajava L. leaves in infectious diarrhoea. BMC Complementary and Alternative Medicine 10:33 www.biomedcentral.com/1472-6882/10/33
52 MISA C, HERNANDEZ N, ABRAHAM A, 1979
Contribution to the biological evaluation of Cuban plants. I. Rev Cubana Med Trop 31:5-12.
53 CACERES A, JAUREGUI E, HERRERA D, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatomucosal infections. 1: Screening of 38 plant extracts for anticandidal activity. J Ethnopharmacol 33(3):277-283.
54 GNAN SO, DEMELLO MT, 1999
Inhibition of Staphylococcus aureus by aqueous goiaba extracts. J Ethnopharmacology 68(1-3):103-108.
55 LOZOYA X, BECERRIL G, MARTINEZ M, 1990
Intraluminal perfusion model of in vitro guinea pig ileum as a model of study of the antidiarrheic properties of guava (Psidium guajava). Arch Invest Med (Mex) 21:155-162.
56 LUTTERODT G, 1992
Inhibition of microlax-induced experimental diarrhea with narcotic-like extracts of Psidium guajava leaf in rats. J Ethnopharmacol 37(2):151-157.
57 OJEWOLE JA, AWE EO, CHIWORORO WD, 2008
Antidiarrhoeal activity of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract in rodents. J Smooth Muscle Res 44(6):195-207.
58 WEI L, LI Z, CHEN B, 2000
Clinical study on treatment of infantile rotaviral enteritis with Psidium guajava L. Zhongguo Zhong Xi Yi Jie He Za Zhi 20(12):893-895.
59 LOZOYA X, REYES H, CHAVEZ MA, MARTINEZ MC, SOTO Y, DOUBOVA SV, 2002
Intestinal anti-spasmodic effect of a phytodrug of Psidium guajava folia in the treatment of acute diarrheic disease. J Ethnopharmacol 83(1-2):19-24.
60 ABDELRAHIM SI, ALMAGBOUL AZ, OMER ME, ELEGAMI A, 2002
Antimicrobial activity of Psidium guajava L. Fitoterapia 73(7-8):713-715.
61 TONA L, KAMBU K, NGIMBI N, MESIA K, PENGE O, LUSAKIBANZA M, CIMANGA K, DE BRUYNE T, APERS S, TOTTE J, PIETERS L, VLIETINCK AJ, 2000
Antiamoebic and spasmolytic activities of extracts from some antidiarrhoeal traditional preparations used in Kinshasa, Congo. Phytomedicine 7(1):31-38.
62 MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BOUCOURT E, MORON F, 2000
Actividad genotóxica in vitro de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
63 BETANCOURT J, RAMOS A, VIZOSO A, MARTÍNEZ MJ, LOPEZ M, 2000
Ausencia de actividad genotóxica del extracto fluido de Psidium guajava L (guayaba) evaluada en un sistema de ensayo de Aspergillus nidulans. Rev Cubana Planta Med 5(2):38-40.
64 MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BARCELO H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORON F, 2000
Toxicidad aguda clásica de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
65 MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BARCELO H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORON F, 2000
Toxicidad aguda de hoja de Psidium guajava L. en el modelo de clases tóxicas agudas. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
66 LOPEZ M, MOREJON Z, MARTINEZ MJ, BACALLAO Y, FUENTES V, 2009
Toxicidad aguda oral a dosis repetidas de decocción al 50% de hojas frescas de Psidium guajava L. Investigación TRAMIL. Facultad de Ciencias Médicas “Dr. Salvador Allende”, Laboratorio Central de Farmacología, La Habana, Cuba.
67 PAZOS L, COTO T, GONZALEZ S, 2006
Toxicidad oral aguda dosis repetida, en ratón, del extracto de la corteza fresca de Psidium guajava. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
68 PAZOS L, COTO T, GONZALEZ S, 2006
Irritabilidad dérmica, piel sana en conejos, de hoja por decocción de Psidum guajava. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
69 PEREZ GUTIERREZ RM, MITCHELL S, VARGAS SOLIS R, 2008
Psidium guajava: A review of its traditional uses, phytochemistry and pharmacology. J Ethnopharmacol 117(1):1-27.