Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Panama:
- marañón
- po'm kajou
Distribution géographique
Originaire d'Amérique tropicale, cultivée sous les tropiques.
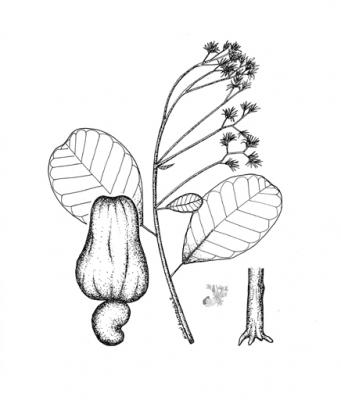
Description botanique
Arbre pouvant atteindre 10 m de haut. Feuilles pétiolées, coriaces, oblongues-elliptiques à arrondies-elliptiques, arrondies à la pointe, aiguës ou obtuses à la base. Fleurs en panicules terminales, pétales pourpres linéaires-lancéolés. Noix réniforme, grise, sur un hypocarpe (pédoncule hypertrophié), épais, un peu spongieux, juteux, rouge ou jaune.
Voucher(s)
FLORPAN, 1870, PMA
Pharmacopée
Ed.3References
1 SOLÍS P, CORREA M, GUPTA M, 1995
Encuesta TRAMIL (Comunidades afro-caribeñas). Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
2 A SOLÍS PN, ESPINOSA A, DE GRACIA J, MARTÍNEZ L, GUPTA MP, 2003
Encuesta TRAMIL-GEF Ngöbe-Buglé. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá.
3 MELO CAVALCANTE AA, RUBENSAM G, PICADA JN, GOMES DA SILVA E, FONSECA MOREIRA JC, HENRIQUES JA, 2003
Mutagenicity, antioxidant potential, and antimutagenic activity against hydrogen peroxide of cashew (Anacardium occidentale) apple juice and cajuina. Environ Mol Mutagen 41(5):360-369.
4 SATYNARAYANA D, MYTHIRAYEE C, KRISHNAMURTY V, MADHAVAKRISHNA W, 1978
Studies on the polyphenols of cashew apple (Anacardium occidentale). Leather Sci (Madras) 25:51-54.
5 KUBO J, LEE JR, KUBO I, 1999
Anti-Helicobacter pylori agents from the cashew apple. J Agr Food Chem 47(2):533-537.
6 KUBO I, OCHI M, VIERA PC, KOMATSU S, 1993
Antitumor agents from the cashew (Anarcadium occidentale) apple juice. J Agr Food Chem 41(6):1012-1015.
7 MAC LEOD AJ, DE TROCONIS NG, 1982
Volatile flavour components of cashew apple (Anacardium occidentale). Phytochemistry 21(10):2527-2530.
8 PRICE RL, HOLANDA LF, MOURA FE, MAIA GA, MARTIN CB, 1975
Constituents of Brazilian cashew apple juice. Cienc Agron 5(1):61.
9 GARG SC, KASERA HL, 1984
Antibacterial activity of the essential oil of Anacardium occidentale. Indian Perfum 28(2):95-97.
10 ARYA R, BABU V, ILYAS M, NASIM KT, 1989
Phytochemical examination of the leaves of Anarcadium occidentale. J Indian Chem Soc 66(1):67-68.
11 MARTÍNEZ Y, MARTÍNEZ O, ESCALONA A, SOTO F, VALDIVIE M, 2012
Composición química y tamizaje fitoquímico del polvo de hojas y retoños del Anacardium occidentale L. (marañón). Revista Cubana de Plantas Medicinales. 17(1)1-10.
12 SOLÍS PN, RODRÍGUEZ N, ESPINOSA A, GUPTA MP, 2004
Estudio antimicrobiano de algunas plantas TRAMIL con usos en Martinica. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
13 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Velocidad del tránsito intestinal en ratones, del extracto acuoso de hojas nuevas frescas de Anacardium occidentale. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
14 GONCALVES JL, LOPES RC, OLIVEIRA DB, COSTA SS, MIRANDA MM, ROMANOS MT, SANTOS NS, WIGG MD, 2005
In vitro anti-rotavirus activity of some medicinal plants used in Brazil against diarrhea. J Ethnopharmacol 99(3):403-407.
15 EICHBAUM FW, 1949
Biological properties of anacardic acid O-penta-decadienyl-salicylic acid and related compounds. Memorias do Instituto Butantá 19:119-133.
16 LAURENS A, MBOUP S, GIONO-BARBER P, SYLLA O, DAVID-PRINCE LM,1982
Study of antimicrobial activity of Anacardium occidentale L Ann Pharm Fr 40(2):143-146.
17 DE SOUZA CP, 1992
The use of the shell of the cashew nut, of Anacardium occidentale, as an alternative molluscicide. Rev Inst Med Trop Sao Paulo, Brazil 34(5):459-466.
18 TYMAN JH, KIONG LS, 1978
Long chain phenol: part XI; Composition of natural cashew nut-shell liquid (Anacardium occidentale) from various sources. Lipids 13:525-532.
19 KUBO I, KINST-HORI I, YOKOKAWA Y, 1994
Tyrosinase inhibitors from Anacardium occidentale fruits. J Nat Prod 57(4):545-551.
20 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Toxicidad aguda (5000 mg/kg) dosis repetida, en ratones, del extracto acuoso de hojas nuevas frescas de Anacardium occidentale. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
21 GARCÍA-GONZÁLEZ M, BARBOZA CJ, 2005
Toxicidad aguda (3000 mg/kg) dosis repetida, en ratones, del extracto acuoso de hojas nuevas frescas de Anacardium occidentale. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
22 LIOGIER HA, 1990
Plantas medicinales de Puerto Rico y del Caribe. San Juan, Puerto Rico: Iberoamericana de Ediciones. p201.