Aloe vera
Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Trinité-et-Tobago:
- aloe
Barbade:
- aloe
Guadeloupe:
- lalwé
Vénézuéla:
- sábila
Porto Rico:
- sábila
Distribution géographique
Originaire du bassin méditerranéen, largement cultivée en milieu tropical et subtropical.
Description botanique
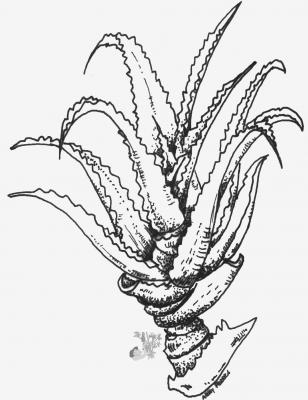
Plante acaule (sans tige apparente) ou à tige courte, stolonifère. Feuilles charnues lancéolées, longues de 30 à 60 cm, terminées en pointe fine, épino-dentées. Inflorescence sur stipe pouvant atteindre 1,2 m avec bractées lancéolées ou ovées, en pointe; fleurs jaunes de 2,5 cm de longueur en grappes denses de 10 à 30 cm. Capsule (fruit) déhiscente contenant des graines noires.
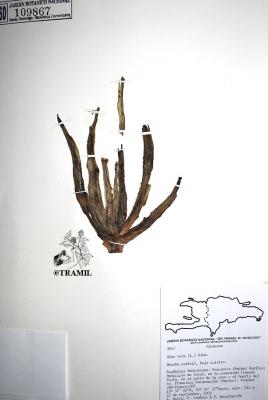
Voucher(s)
Jiménez, 1525, JBSD
Mejía, 12, MAPR
Faujour, 5, BAR
Delaigue, 1, NHTT
Boulogne, TH3, UAG
Pharmacopée
Ed.3References
1 BENEDETTI MD, 1994
Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
2 ZAMBRANO LE, 2007
Encuesta TRAMIL en Guareguare, Miranda. UCV, Caracas, Venezuela.
3 FAUJOUR A, MURREY D, CHELTENHAM-CORBIN B, CARRINGTON S, 2003
TRAMIL survey. enda-caribbean, IICA & UAG, Saint Thomas, Barbados.
4 DELAIGUE J, 2005
TRAMIL survey. UAG & PRDI, Tobago House of Assembly, Scarborough, Tobago.
5 BALZ E, BOYER A, BURAUD M, 2007
Enquête TRAMIL à Marie-Galante. U. Bordeaux 3, U. Paris XI Chatenay-Malabry, UAG, Guadeloupe.
6 BOULOGNE I, 2008
Enquête TRAMIL, Les Saintes, UAG, Guadeloupe (FWI).
7 MEDLINE PLUS 2009
Aloe (Aloe vera L.) U.S. National Library of Medicine and the National Institutes of Health. URL: www.nlm.nih.gov/medlineplus/druginfo/natural/patient-aloe.html
8 GRUENWALD J, BRENDLER T, JAENICKE C, 2004
Physicians’ Desk Reference for Herbal Medicines, Third Edition. Montvale, NJ, USA: Thomson Healthcare, Inc. 988pp.
9 DUKE’S PHYTOCHEMICAL AND ETHNOBOTANICAL DATABASES 2009
www.ars-grin.gov/duke/
10 HOLDSWORTH DK, 1971
Chromones in Aloe species. Part I. Aloesin-A C-glucosyl-7-hydroxychromone. Planta Med 19:322-325.
11 MARY NY, CHRISTENSEN BV, BEAL JL, 1956
A paper chromatographic study of Aloe, aloin and cascara sagrada. J Am Pharm Assoc Sci Ed 45:229-232.
12 PASZKIEWICZ-GADEK A, CHLABICZ J, GALASINSKI W, 1988
The influence of selected potential oncostatics of plant origin on the protein biosynthesis in vitro. Pol J Pharmacol Pharm 40(2):183-190.
13 RAUWALD H, 1987
New hydroxyaloins: the periodate-positive substance from cape aloes and cinnamoyl esters from Curacao aloes. Pharm Weekbl (Sci Ed) 9(4):215.
14 ZWAVING JH, ELEMA ET, 1976
A comparative investigation of two methods for the determination of 1,8-dihydroxyanthracene derivatives in vegetable drugs. Pharm Weekb (Sci Ed) 111:1315.
15 WALLER GR, MANGIAFICO S, RITCHEY CR, 1978
A chemical investigation of Aloe barbadensis. Proc Okla Acad Sci 58:69.
16 WALLER GR, MANGIAFICO S, RITCHEY CR, CUMBERLAND CD, 1978
Natural products from Aloe barbadensis Miller. Lloydia 41:648A.
17 SUGA T, HIRATA T, 1983
The efficacy of the Aloe plants chemical constituents and biological activities. Cosmet Toiletries 98(6):105-108.
18 GUARDARRAMA I, HERNÁNDEZ M, DÍAZ-ACOSTA A, CARBALLO A, 1993
Observaciones clínicas sobre el efecto del Aloe barbadensis L. en el tratamiento de pacientes asmáticos. Estudio preliminar. Informe TRAMIL. Instituto Superior de Ciencias Médicas, Santa Clara, Cuba.
19 GUARDARRAMA I, TORRES O, HERNÁNDEZ M, RUIZ MM, GÓMEZ M, CLAVO Y, 1994
Prueba de hiperreactividad bronquial a la carbacolina en pacientes asmáticos tratados con Aloe barbadensis. Medicentro 10(1):93-101.
20 MARTÍNEZ MJ, BETANCOURT J, ALONSO N, 1996
Ausencia de actividad antimicrobiana de un extracto acuoso liofilizado de Aloe vera (sábila). Rev Cubana Plantas Med 1(3):18-20.
21 HEGGERS JP, PINELESS GR, ROBSON MC, 1979
Dermaide Aloe/Aloe vera gel: Comparison of the antimicrobial effects. J Amer Med Technol 41:293-294.
22 GOTTSHALL RY, LUCAS E, LICKFELDT A, ROBERTS J, 1949
The occurrence of antibacterial substances active against Mycobacterium tuberculosis in seed plants. J Clin Invest 28:920-923.
23 LORENZETTI LJ, SALISBURY R, BEAL JL, BALDWIN JN, 1964
Bacteriostatic property of Aloe vera. J Pharm Sci 53:1287.
24 MOHSIN A, SHAH AH, AL-YAHYA MA, TARIQ M, TANIRA MO, AGEEL AM, 1989
Analgesic antipyretic activity and phytochemical screening of some plants used in traditional Arab system of medicine. Fitoterapia 60(2):174-177.
25 FURONES JA, MORÓN FJ, PINEDO Z, 1996
Acción analgésica de un extracto acuoso liofilizado de Aloe vera L. en ratones. Rev Cubana Plant Med 1(2):15-17.
26 DAVIS RH, LEITNER MG, RUSSO JM, BYRNE ME, 1989
Wound healing. Oral and topical activity of Aloe vera. J Am Podiatr Med Assoc 79(11):559-562.
27 YAGI A, SHIDA T, NISHIMURA H, 1987
Effect of amino acids in Aloe extract on phagocytosis by peripheral neutrophil in adult bronchial asthma. Jap J Allergol 36(12):1094-1101.
28 ATHERTON P, 1998
First aid plant. Chem Brit 34(5):33-36.
29 NAKAYAMA T, 1993
Hair cosmetics containing Aloe extract. Patent-Japan Kokai Tokkyo Koho-05 331,024:3. Chemical Abstracts 12191297H.
30 EL ZAWAHRY M, HEGAZY MR, HELAL M, 1973
Use of Aloe in treating leg ulcers and dermatoses. Int J Dermatol 12:68-73.
31 KAVOUSSI H, KAVOUSSI HP, 1993
Saturated solution of purified sodium chloride in purified Aloe vera for inducing and stimulating hair growth and for decreasing hair loss. Patent - USA: 5,215,760.
32 BUNYAPRAPHATSARA N, JIRAKULCAIWONG S, THIRAWARAPAN S, MANONUKUL J, 1996
The efficacy of Aloe vera cream in the treatment of first, second and third degree burns in mice. Phytomedicine 2(3):247-251.
33 ROWE TD, LOVELL BK, PARKS LM, 1941
Further observations on the use of Aloe vera leaf in the treatment of third degree X-ray reactions. J Am Pharm Assoc Sci Ed 30:266-269.
34 SAMBOONWONG J, THANAMITTRAMANEE S, JARIYAPONGSKUL A, PATUMRAJ S, 2000
Therapeutic effects of Aloe vera on cutaneous microcirculation and wound healing in second degree burn model in rats. J of the Medical Association of Thailand 83(4):417-425.
35 DAVIS RH, DONATO J, HARTMAN G, HAAS R, 1994
Anti-inflammatory and wound healing activity of a growth substance in Aloe vera. J Am Podiatr Med Assoc 84(2):77-81.
36 DAVIS RH, LEITNER MG, RUSSO JM, 1987
Topical anti-inflammatory activity of Aloe vera as measured by ear swelling. J Am Podiatr Med Assoc 77(11):610-612.
37 DAVIS RH, LEITNER MG, RUSSO JM, 1988
Aloe vera. A natural approach for treating wounds, edema and pain in diabetes. J Am Podiatr Med Assoc 78(2):60-68.
38 DAVIS RH, KABBANI JM, MARO NP, 1987
Aloe vera and wound healing. J Amer Podiatr Med Ass 77(4):165-169.
39 DAVIS RH, LEITNER MG, RUSSO JM, BYRNE ME, 1989
Anti-inflammatory activity of Aloe vera against a spectrum of irritants. J Amer Podiatr Med Ass 79(6):263-276.
40 DAVIS RH, AGNEW PS, SHAPIRO E, 1986
Antiarthritic activity of anthraquinones found in Aloe for podiatric medicine. J Am Podiatr Med Assoc 76:61-66.
41 STRICKLAND FM, PELLEY RP, KRIPKE ML, 1994
Prevention of ultraviolet radiation-induced suppression of contact and delayed hypersensitivity by Aloe barbadensis gel extracts. J Invest Dermatol 102(2):197-204.
42 LEE CK, HAN SS, MO YK, KIM RS, CHUNG MH, PARK YI, LEE SK, KIM YS, 1997
Prevention of ultraviolet radiation-induced suppression of accessory cell function of Langerhans cells by Aloe vera gel component. Immunopharmacology 37(2/3):153-162.
43 RODRÍGUEZ-BIGAS M, CRUZ NI, SUÁREZ A, 1988
Comparative evaluation of Aloe vera in the management of burn wounds in guinea pigs. Plast Reconstr Surg 81:386-389.
44 KIVETT WF, 1989
Aloe vera for burns. Plastic and Reconstructive Surgery 83:195.
45 DAVIS RH, DI DONATO JJ, JOHNSON RW, STEWART CB, 1994
Aloe vera, hydrocortisone, and sterol influence on wound tensile strength and anti-inflammation. J Am Podiatr Med Assoc 84(12):614-621.
46 LUSHBAUGH CC, HALE DB, 1953
Experimental acute radiodermatitis following beta irradiation. V. Histopathological study of the mode of action of therapy with Aloe vera. Cancer 6:690-698.
47 ROVATTI B, BRENNAN RJ, 1959
Experimental thermal burns. Induct Med Surg 28:364.
48 NORTHWAY RB, 1975
Experimental use of Aloe vera extract in clinical practice. Vet Med Small Animal Clinic 70:89.
49 COBBLE HH, 1975
Stabilized Aloe vera gel. Patent - USA: 3,892,853.
50 FULTON JE, 1990
The stimulation of postdermabrasion wound healing with stabilized Aloe vera gel-polyethylene oxide dressing. J Dermatol Surg Oncol 16(5):460-467.
51 DAVIS RH, KABBANI JM, MARO NP, 1986
Wound healing and antiinflammatory activity of Aloe vera. Proceedings of the Pennsylvania Academy of Sciences 60:79.
52 DAVIS RH, LEITNER MG, RUSSO JM, MARO NP, 1987
Biological activity of Aloe vera. Med Sci Res 15:235.
53 LANG L, FEAKINS RM, GOLDTHORPE S, HOLT H, TSIRONI E, DE SILVA A, JEWELL DP, RAMPTON DS, 2004
Randomized, bouble-blind, placebo-controlled triall of oral Aloe vera gel for active ulcerative colitis. Aliment Pharmacol Ther 19(7):739-747.
54 THOMPSON JE, 1991
Topical use of Aloe vera derived Allantoin gel in otolaryngology. Ear Nose Throat J 70(2):119.
55 LEÓN JE, ROSALES V, ROSALES RA, PAVÓN V, 1999
Actividad antiinflamatoria y cicatrizante del ungüento rectal de Aloe vera L (sábila). Rev Cubana Plantas Med 4(3):106-109.
56 SARABIA JEL, CLARES VPR, CLARES RAR, HERNÁNDEZ VP, 1999
Actividad antiinflamatoria y cicatrizante del unguento rectal de Aloe vera L. (Sabila) Rev Cubana Plant Med 3(3):106-109.
57 VISUTHIKOSOL V, CHOWCHUEN B, SUKWANARAT Y, SRIURAIRATANA S, BOONPUCKNAVIG V, 1995
Effect of Aloe vera gel to healing of burn wound a clinical and histologic study. J Med Assoc Thai 78(8):403-409.
58 CREWE JE, 1939
Aloes in the treatment of burns and scalds. Minnesota Med 22:538-539.
59 HORMANN HP, KORTING HC, 1994
Evidence for the efficacy and safety of topical herbal drugs in dermatology: Part I: Anti-inflammatory agents. Phytomedicine 1(2):161-171.
60 LEUNG AY, 1977
Aloe vera in cosmetics. Drug Cosmet Ind 120:34.
61 BERNHARD JD, 1988
Aloe vera and vitamin E as dermatologic remedies. J Amer Med Ass 259(1):101.
62 COLLINS CE, COLLINS C, 1935
Roentgen dermatitis treated with fresh whole leaf of Aloe vera. Amer J Roentgen 33:396.
63 LOVEMAN AB, 1937
Leaf of Aloe vera in treatment of roentgen ray ulcers: report on two additional cases. Arch Dermatol Syphilol 36:838.
64 WRIGHT CS, 1936
Aloe vera in the treatment of roentgen ulcers and telangiectasis. J Amer Med Ass 106:1363-1364.
65 BARNES TC, 1947
The healing action of extracts of Aloe vera leaf on abrasions of human skin. Amer J Bot 34:597.
66 KESTEN B, MC LAUGHLIN R, 1936
Roentgen ray dermatitis treated with ointment containing viosterol. Arch Dermatol Syphilol 34:901-903.
67 MARET RH, COBBLE HR, 1975
Extracts of Aloe vera. Patent-US-3,878,197. Chemical Abstracts 8348187G.
68 MAENTHAISONG R, CHAIYAKUNAPRUK N, NIRUNTRAPORN S, KONGKAEW C, 2007
The efficacy of Aloe vera used for burn wound healing: a systematic review. Burns 33(6):713-718.
69 DAVIS RH, 1996
Aloe plant for promotion of wound healing. Patent-US-5,487,899:11. Chemical Abstracts 124270551V.
70 SCHULMAN JM, 1996
Medicated gels for healing aphthous ulcers. Patent-US-5,503,822:3. Chemical Abstracts 124298476Y.
71 LERNER FN, 1987
Investigation of effects of proteolytics enzymes, Aloe gel, and iontophoresis on chronic and acute athletic injuries. Chiropractic Sports Med 1(3):106-110.
72 VERMA SBS, SCHULZE HJ, STEIGLEDER GK, 1989
The effect of externally applied remedies containing Aloe vera gel on the proliferation of epidermis. Parfumerie Und Kometik 70(8):452-459.
73 SAYED MD, 1980
Traditional medicine in health care. J Ethnopharmacol 2(1):19-22.
74 DOMÍNGUEZ-SOTO L, 1992
Photodermatitis to Aloe vera. Int J Dermatol 31(5):372.
75 SYED T, AHMAD S, HOLT A, AHMAD S, AHMAD S, AFZAL M, 1996
Management of psoriasis with Aloe vera extract in a hydrophilic cream: a placebo-controlled, double-blind study. Trop Med Int Health 1(4):505-509.
76 COUTTS BC, 1979
Stabilized Aloe vera gel. Patent-Japan Kokai Tokkyo Koho-79 119,018:6. Chemical Abstracts 9299563V.
77 RAMOS A, EDREIRA AYMEE, VILLESCUSA A, VIZOZO A, MARTÍNEZ MJ, 1996
Evaluación genotóxica de un extracto acuoso de Aloe vera L. Rev Cubana Plantas Med 1(2):18-23.
78 VIZOSO A, RAMOS A, GARCÍA A, PILOTO J, PAVÓN V, 2000
Estudio genotóxico in vitro e in vivo del extracto fluido de Cassia grandis L y el gel de Aloe vera L. Rev Cubana Plantas Med 5(3):91-96.
79 SETHI N, NATH D, SING R, 1989
Teratological evaluation of some commonly used indigenous antifertility plants in rats. Int J Crude Drug Res 27(2):118-120.
80 GOSWAMI CS, BOKADIA MM, 1979
The effect of extracts of Aloe barbadensis leaves on the fertility of female rats. Indian Drugs 16:124-125.
81 IKENO Y, HUBBARD GB, LEE S, YU BP, HERLIHY JT, 2002
The influence of long-term Aloe vera ingestion on age-related disease in male Fischer 344 rats. Phytother Res 16(8):712-718.
82 YOKEL R, OGZEWALLA C, 1981
Effects of plants ingestion in rats determined by the conditioned taste aversion procedure. Toxicon 19(2):223-232.
83 PRAKASH A, MATHUR R, 1976
Screening of Indian plant for antifertility activity. Indian J Exp Biol 14:623-626.
84 PARRA AL, YHEBRA RS, SARDINAS IG, BUELA LI, 2001
Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
85 SHAH AH, QURESHI S, TARIQU M, AGEEL AM, 1989
Toxicity studies on six plants used in the traditional Arab system of medicine. Phytother Res 3(1):25-29.