Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Guadeloupe:
- ail
- lay
Guatemala:
- ajo
République dominicaine:
- ajo
Barbade:
- garlic
Haïti:
- lay
Sainte-Lucie:
- lay
Distribution géographique
D'origine euroasiatique, cultivée partout dans le monde.
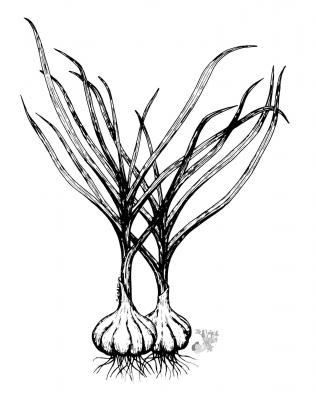
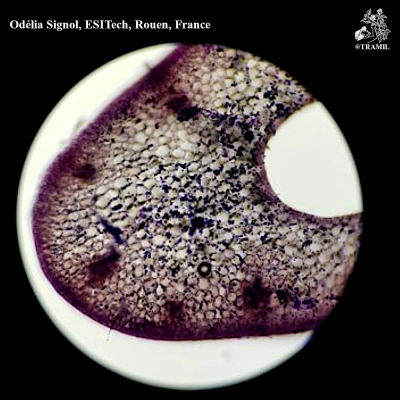
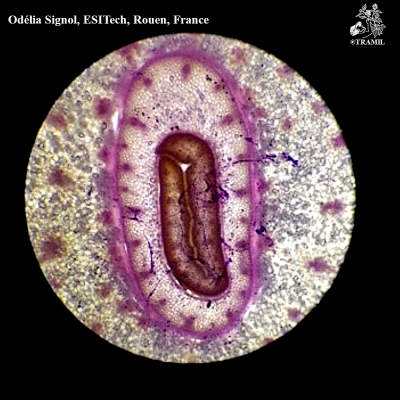
Description botanique
Plante herbacée à bulbes divisés et enveloppés d’une peau blanchâtre. Feuilles planes, de 2-3 cm de largeur. Inflorescence en hampe d’environs 50 cm; ombelle dense; fleurs rosées avec ovaire oblong-ovoïde.
Voucher(s)
Faujour, 14, BAR
Girón, 254, CFEH
Jiménez, 1519, JBSD
Fuentes, 4635, ROIG
Boulogne, TB1&TH2, UAG
Pharmacopée
Ed.3References
1 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d’Entraide SOE, Port au Prince, Haïti.
2 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
3 GIRÓN L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
4 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
5 JEAN-PIERRE L, 1988
TRAMIL survey. St. Lucia National Herbarium, Castries, St Lucia.
6 FAUJOUR A, MURREY D, CHELTENHAM-CORBIN B, CARRINGTON S, 2003
TRAMIL survey. enda-caribbean, IICA & UAG, Saint Thomas, Barbados.
7 BOULOGNE I, 2008
Enquête TRAMIL, Les Saintes, UAG, Guadeloupe (FWI).
8 NATURAL STANDARD, 2010
Garlic (Allium sativum L.). Foods, Herbs & Supplements. www.naturalstandard.com/monographs/herbssupplements/garlic. Last updated 5/17/2010.
9 GRUENWALD J, BRENDLER T, JAENICKE C, 2004
Physicians’ Desk Reference for Herbal Medicines, Third Edition. Montvale, NJ, USA: Thomson Healthcare, Inc. 988pp.
10 BRINKER FND, 2001
Herb contraindications and drug interactions. 3° edition. Sandy, Oregon, USA: Eclectic Medical Publications.
11 ARTECHI A (Ed.), 1998
Fitoterapia Vademécum de prescripción de Plantas Medicinales. Barcelona, España: Masson. p63.
12 ALONSO JR, 1998
Tratado de fitomedicina. Bases clínicas et farmacológicas. Buenos Aires, Argentina: Ed. ISIS S.R.L. p208.
13 QUILEZ AM, GARCÍA D, SÁENZ T, 2009
Uso racional de medicamentos a base de plantas. Guía de interacciones entre fitomedicamentos et fármacos de síntesis. Sevilla, España: 1a Edición Fundación Farmacéutica Avenzoar.
14 MEDLINE PLUS, 2009
Ajo (Allium sativum L.). Biblioteca Nacional de Medecina de EE.UU et los Institutos Nacionales de la Salud. URL: www.nlm.nih.gov/medlineplus/spanish/druginfo/natural/patient-garlic.htm….
15 CAPORASO N, SMITH S, ENG R, 1983
Antifungal activity in human urine and serum after ingestion of garlic. Antimicob Agents Chemother 23(5):700-702.
16 PISCITELLI SC, BURSTEIN AH, WELDEN N, GALLICANO KD, FALLOON J, 2002
The effect of garlic supplements on the pharmacokinetics of saquinavir. Clinical infectious diseases 34(2):234-238.
17 GALLICANO K, FOSTER B, CHOUDHRI S, 2003
Effect of short-term administration of garlic supplements on single-dose ritonavir pharmacokinetics in healthy volunteers. British J of Clinical Pharmacology 55(2):199-202.
18 MARKOWITZ JS, DEVANE CL, CHAVIN KD, TAYLOR RM, RUAN Y, DONOVAN JL, 2003
Effects of garlic (Allium sativum L.) supplementation on cytochrome P450 2D6 and 3A4 activity in healthy volunteers. Clin Pharmacol Ther 74(2):170-177.
19 AL-NAGDY SA, ABDEL-RAHMAN MO, HEIBA HI, 1988
Evidence for some prostaglandins in Allium sativum extracts. Phytother Res 2:4196-4197.
20 ROLLERI F, 1943
Occurrence of nicotinic acid and nicotinamide in curative plants. Arch Pharm (Weinheim) 281:118.
21 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Ratón, USA: CRC Press. p13.
22 DR. DUKE’S PHYTOCHEMICAL AND ETHNOBOTANICAL DATABASES, 2009
www.ars-grin.gov/duke/
23 KOCH HP, JAGER W, GROH U, HOVIE JE, PLANK G, SEDLAK U, PRAZNIK W, 1993
Carbohydrates from garlic bulbs (Allium sativum L.) as inhibitors of adenosine deaminase enzyme activity. Phytother Res 7(5):387-389.
24 BAUMGARTNER S, DAX TG, PRAZNIK W, FALK H, 2000
Characterisation of the high-molecular weight fructan isolated from garlic (Allium sativum L.). Carbohydr Res 328(2):177-183.
25 RAKHIMBAEV IR, OL’SHANSKAYA RV, 1981
Preliminary identification of natural gibberellins of garlic. Izv Akad Nauk Kaz Ssr Ser Biol 2:17-22.
26 INAGAKI M, HARADA Y, YAMADA K, ISOBE R, HIGUCHI R, MATSUURA H, ITAKURA Y, 1998
Isolation and structure determination of cerebrosides from garlic, the bulbs of Allium sativum L. Chem Pharm Bull 46(7):1153-1156.
27 SENDL A, ELBL G, STEINKE B, REDL K, BREU W, WAGNER H, 1992
Comparative pharmacological investigations of Allium ursinum and Allium sativum. Planta Med 58(1):1-7.
28 MOCHIZUKI E, YAMAMOTO T, KOMIYAMA Y, NAKAZAWA H, 1998
Identification of Allium products using flame photometric detection gas chromatography and distribution patterns of volatile sulfur compounds. J Agr Food Chem 46(12):5170-5176.
29 UEDA Y, SAKAGUCHI M, HIRAYAMA K, MIYAJIMA R, KIMIZUKA A, 1990
Characteristic flavor constituents in water extract of garlic. Agr Biol Chem 54(1):163-169.
30 LAWSON LD, WOOD SG, HUGHES BG, 1991
hplc analysis of allicin and other thiosulfinates in garlic clove homogenates. Planta Med 57(3):263-270.
31 MUTSCH-ECKNER M, ERDELMEIER CAJ, STICHER O, REUTER HD, 1993
A novel amino acid glycoside and three amino acids from Allium sativum. J Nat Prod 56(6):864-869.
32 PENG JP, CHEN H, QIAO YQ, MA LR, NARUI T, SUZUKI H, OKUYAMA T, KOBAYASHI H, 1996
Two new steroidal saponins from Allium sativum and their inhibitory effects on blood coagulability. Yao Hsueh Hsueh Pao 31(8):607-612.
33 MATSUURA H, USHIROGUCHI T, ITAKURA Y, FUWA T, 1989
Further studies on steroidal glycosides from bulbs, roots and leaves of Allium sativum L. Chem Pharm Bull 37(10):2741-2743.
34 VICTORIA MdC, MORÓN FJ, MARTÍNEZ I, BRITO G, FUENTES V, 2011
Efecto antipirético de la decocción 30% de bulbo fresco machacado de Allium sativum (ajo) en ratas. Informe TRAMIL. Facultad de Ciencias Médicas “Dr. Salvador Allende”, Laboratorio Central de Farmacología, La Habana, Cuba.
35 SHARMA V, SETHI M, KUMAR A, RAROTRA JR, 1977
Antibacterial property of Allium sativum in vivo & in vitro studies. Indian J Exp Biol 15:466.
36 SHAMS M, SHOKOOHAMIRI MR, AMIRRAJAB N, MOGHADASI B, GHAJARI A, ZEINI F, SADEGHI G, RAZZAGHI M, 2006
In vitro antifungal activities of Allium cepa, Allium sativum and ketoconazole against some pathogenic yeasts and dermatophytes. Fitoterapia 77:321-323.
37 MOLINA NM, 1992
Actividad antimicrobiana de extractos de Allium sativum. Evaluación preclínica, farmacológica et toxicológica (Tesis de graduación). Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
38 EL-TANBOULY ND, ABDEL-MEGID RM, 1994
HPLC determination of alliin in garlic and garlic products and their antimicrobal activity. Zagazig J Pharm Sci 3(3A):120-124.
39 CÁCERES A, GIRÓN LM, ALVARADO SR, TORRES MF, 1987
Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharmacol 20(3):223-237.
40 KABELIK J, 1970
Antimicrobial properties of garlic. Pharmazie 25(4):266-270.
41 ADETUMBI M, JAVOR GT, LAU BH, 1986
Allium sativum (garlic) inhibits lipid synthesis by Candida albicans. Antimicrob Agents Chemother 30(3):499-501.
42 APPLETON JA, TANSEY MR, 1975
Inhibition of growth of zoopathogenic fungi by garlic extract. Mycologia 67:882-885.
43 PLODDEE A, PALAKORNKOL R, 1977
Antifungal activity of garlic. Undergraduate Special Project Report 1977:23.
44 DELAHA EC, GARAGUSI VF, 1985
Inhibition of mycobacteria by garlic extract (Allium sativum ). Antimicrob Agents Chemother 27(4):485-486.
45 FERNÁNDEZ EJ, 1995
Efecto de dos formulaciones hidroalcohólicas de Allium sativum en el tratamiento de patients con dermatofitosis (Tesis de especialidad en farmacología). Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
46 PRASAD G, SHARMA VD, RAO VN, KUMAR A, 1983
Efficacy of garlic (Allium sativum) treatment against dermatophytosis in man and animals. Indian Vet Med J 7(3):161-163.
47 MARTÍNEZ CROVETTO R, 1981
Plantas utilizadas en medicina en el Noroeste de Corrientes. Miscelanea (Fund Miguel Lillo) 69:7-139.
48 ABDEL-GHAFFAR F, SEMMLER M, AL-RASHEID KA, STRASSEN B, FISCHER K, AKSU G, KLIMPEL S, MEHLHORN H, 2011
The effects of different plant extracts on intestinal cestodes and on trematodes. Parasitol Res 108(4):979-984.
49 SOFFAR SA, MOKHTAR GM, 1991
Evaluation of the antiparasitic effect of aqueous garlic (Allium sativum) extract in Hymenolepiasis nana and giardiasis. J Egypt Soc Parasitol 21(2):497-502.
50 NAHED HA, HODA AT, YOMNA IM, 2009
Effects of garlic on albino mice experimentally infected with Schistosoma mansoni: a parasitological and ultrastructural study. Trop Biomed 26(1):40-50.
51 GAAFAR MR, 2012
Efficacy of Allium sativum (garlic) against experimental cryptosporidiosis, Alexandria J of Medicine 48:59–66.
52 DAMRAU F, FERGUSON E, 1949
The modus vivendi of carminative. The therapeutic value of garlic in functional gastrointestinal disorders. Rev Med J 2:757-758.
53 DEBLASI V, DEBROT S, MENOUD A, GENDRE L, SCHOWING J, 1990
Amoebicidal effect of essential oils in vitro. J Toxicol Clin Exp 10:361-373.
54 MARTÍNEZ MJ, MOREJÓN Z, LÓPEZ M, BOUCOURT E, FUENTES V, MORÓN F, 2005
Irritabilidad dérmica primaria de bulbo fresco machacado de Allium sativum L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Medicina “Dr. Salvador Allende”, Cerro, C. Habana, Cuba.
55 MARTÍNEZ MJ, MOREJÓN Z, LÓPEZ M, BOUCOURT E, FUENTES V, MORÓN F, 2005
Clases tóxicas agudas (CTA) de una decocción de bulbo de Allium sativum L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
56 GARNIER G, BEZANGER-BEAUQUESNE L, 1961
Ressources médicinales de la flore française. Paris, France: Ed. Vigot Frères.
57 BOJS G, SVENSSON A, 1988
Contact allergy to garlic used for wound healing. Contact Derm 18(3):179-181.
58 PAPAGEORGION C, CORBET JP, BRANDAO FM, PECEGUEIRO M, BENEZIA C, 1983.
Allergic contact dermatitis to Garlic (Allium sativum L.). Identification of the allergens: the role of mono-di and trisulfides present in garlic. A comparative study in man and animal (guinea pig). Arch Dermatol Res 275(4):229-234.
59 KANEZAWA A, NAKAGAWA S, SUMIYOSHI H, MASAMOTO K, HARADA H, NAKAGAMI S, DATE S, YOKOTA A, NISHIKAWA M, FUWA T, 1984
General toxicity tests of garlic extract preparation contained vitamins (Kyoleopin). Pharmacometrics 27(5):909-929.
60 SUMIYOSHI H, KANEZAWA A, MASAMOTO K, HARADA H, NAKAGAMI S, YOKOTA A, NISHIKAWA M, NAKAGAWA S, 1984
Chronic toxicity test of garlic extract in rats. J Toxicol Sci 9(1):61-75.
61 AL-BEKAIRI AM, SHAH AH, QURESHI S, 1990
Effect of Allium sativum on epididymal spermatozoa, estradiol-treated mice and general toxicity. J Ethnopharmacol 29(2):117-125.
62 HUH K, PARK JM, LEE S-IL, 1985
Effect of garlic on the therapeutic glutathione S-transferase and glutathione peroxidase activity in rat. Arch Pharm Res 8(4):197-203.
63 SITPRIJA S, PLENGVIDHYA C, KANGKAYA V, BHUVAPANICH S, TUNKAYOON M, 1987
Garlic and diabetes mellitus phase III clinical trial. J Med Assoc 70(2):223-227.
64 MC CRINDLE BW, HELDEN E, CONNER WT, 1998
Garlic extract therapy in children with hypercholesterolemia. Arch Pediatr Adolesc Med 152(11):1089-1094.
65 CHUTANI SK, BORDIA A, 1981
The effect of fried versus raw garlic on fibrinolytic activity in man. Therosclerosis 38:417-421.
66 SHARAF A, 1969
Food plant as a possible factor in fertility contrôle. Qual Plant MaterVeg 17:153.
67 CHAUHAN LS, GARG J, BEDI HK, GUPTA RC, BOMB BS, AGARWAL MP, 1982
Effect of onion, garlic and clofibrate on coagulation and fibrinolytic activity of blood in cholesterol fed rabbits. Indian Med J 76(10):126-127.
68 WHO, 2004
Allium sativum. WHO Monographs on selected medicinal plants. Volume 1. Bulbis Alii Sativi. Ginebra, Suiza, Oct.28,2004. URL: www.who.int/medicines/library/trm/medicinalplants/monograph_volume_one…