Allium cepa
Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
République dominicaine:
- cebollín
Haïti:
- zechalot
Distribution géographique
Originaire d’Asie occidentale; sa culture est très répandue dans le monde entier.
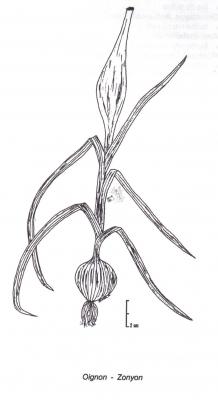
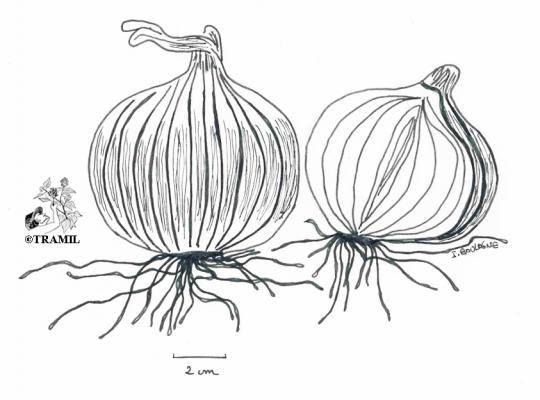
Description botanique
Herbe bulbeuse à écailles, bulbes divisés pouvant atteindre 10 cm de diamètre, tuniqués. Feuilles basales, pouvant atteindre 40 cm, creuses, semi-circulaires en section transversale. Hampe florale pouvant atteindre 60 cm de haut. Fleurs abondantes, violettes ou presque blanches, groupées en une grande ombelle sphérique, de 2 à 3 bractées. Fruit capsulaire. Produit rarement des graines.
Voucher(s)
Germosén-Robineau, 125, JBSD
Boulogne, TH1, UAG
Pharmacopée
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
3 BOULOGNE I, 2009
Enquête TRAMIL, (Terre-de-Bas et Terre-de-Haut) Les Saintes, UAG, Guadeloupe (FWI).
4 AUGUST KT, 1996
Therapeutic values of onion (Allium cepa L.) and garlic (Allium sativum L.). Indian J of Experimental Biology 34(7):634-640.
5 BLOCK E, NAGANATHAN S, PUTMAN D, ZHAO SH, 1992
Allium chemistry: hplc analysis of thiosulfinates from onion, garlic, wild garlic (ramsoms), leek, scallion, shallot, elephant (great-headed) garlic, chive, and Chinese chive. Uniquely high allyl to methyl ratios in some garlic samples. J Agr Food Chem 40(12):2418-2430.
6 WU JB, CHENG YD, HUANG SC, CHANG KH, HSIEH MT, 1992
Quantitative determination of active compounds in Allium genus (Liliaceae) by hplc. China Med Coll J 1(2):123-128.
7 TOKITOMO Y, KOBAYASHI A, 1992
Isolation of the volatile components of fresh onion by thermal desorption cold trap capillary gas chromatography. Biosci Biotech Biochem 56(11):1865-1866.
8 DONNER H, GAO L, MAZZA G, 1997
Separation and characterization of simple and malonylated anthocyanins in red onions, Allium cepa L. Food Res Int 30(8):637-643.
9 FULEKI T, 1969
The anthocyanins of strawberry, rhubarb, radish and onion. J Food Sci 34(4):365-369.
10 PATIL BS, PIKE LM, YOO KS, 1995
Variation in the quercetin content in different colored onions (Allium cepa L.). J Amer Soc Hort Sci 120(6):909-913.
11 SHAMS-GHAHFAROKHI M, SHOKOOHAMIRI MR, AMIRRAJAB N, MOGHADASI B, GHAJARI A, ZEINI F, SADEGHI G, RAZZAGHI-ABYANEH M, 2006
In vitro antifungal activities of Allium cepa, Allium sativum and ketoconazole against some pathogenic yeasts and dermatophytes. Fitoterapia 77:321–323.
12 SRINIVASAN D, NATHAN S, SURESH T, PERUMALSAMY PL, 2001
Antimicrobial activity of certain Indian medicinal plants used in folkloric medicine. J Ethnopharmacol 74(3):217-220.
13 SHARMA KC, SHANMUGASUNDRAM SSK, 1979
Allium cepa as an antiasthmatic. RRL Jammu Newsletter 6(2):8.
14 DORSCH W, ETTL M, HEIN G, SCHEFTNER P, WEBER J, BAYER T, WAGNER H, 1987
Antiasthmatic effects of onion. Inhibition of platelet-activating factor-induced bronchial obstruction by onion oils. Int Arch Allergy Appl Immunol 82(3/4):535-536.
15 DORSCH W, ADAM O, WEBER J, ZIEGELTRUM T, 1985
Antiasthmatic effects of onion extracts -detection of benzyl- and other isothiocyanates (mustard oil) as antiasthmatic compounds of plant origin. Eur J Pharmacol 107(1):17-24.
16 DORSCH W, WAGNER H, 1991
New antiasthmatic drugs from traditional medicine? Int Arch Allergy Appl Immunol 94(1/2):262-265.
17 ROCKWELL P, RAW I, 1979
A mutagenic screening of various herbs spices and food additives. Nutrition and Cancer 1(4):10-16.
18 MAHMOUD II, ALKOFANI AS, ABDELAZIZ AA, 1992
Mutagenic and toxic activities of several spices and some Jordanian medicinal plants. Int J Pharmacog 30(2):81-85.
19 THOMSON M, ALNAQEEB MA, BORDIA T, AL-HASSAN JM, AFZAL M, ALI M, 1998
Effects of aqueous extract of onion on the liver and lung of rats. J Ethnopharmacol 61(2):91-99.
20 VERHOEFF J, HAJER R, VAN DEN INGH TS, 1985
Onion poisoning of young cattle. Vet Rec 117(19):497-498.
21 BEATTY ER, O'REILLY JD, ENGLAND TG, MCANLIS GT, YOUNG IS, GEISSLER CA, SANDERS TA, WISEMAN H, 2000
Effect of dietary quercetin on oxidative DNA damage in healthy human subjects. Br J Nutr 84(6):919-925.
22 GRUENWALD J, BRENDLER T, JAENICKE C, 2004
Physicians’ Desk Reference for Herbal Medicines, Third Edition. Montvale, NJ, USA: Thomson Healthcare, Inc. 988pp.
23 VALDIVIESO R, SUBIZA J, VARELA-LOSADA S, SUBIZA JL, NARGANES MJ, MARTINEZ-COCERA C, CABRERA M, 1994
Bronchial asthma, rhinoconjunctivitis, and contact dermatitis caused by onion. J of Allergy Clin Immunol 94(5):928-930.