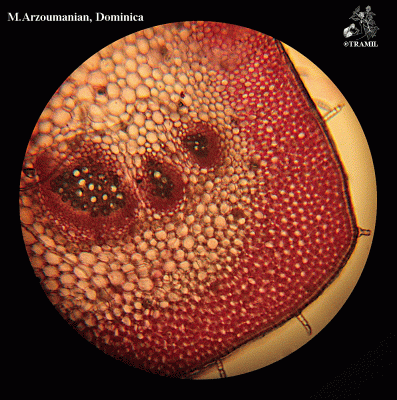
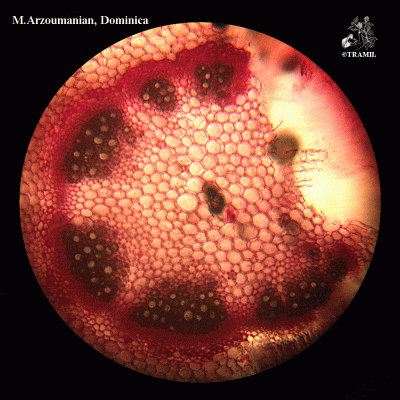
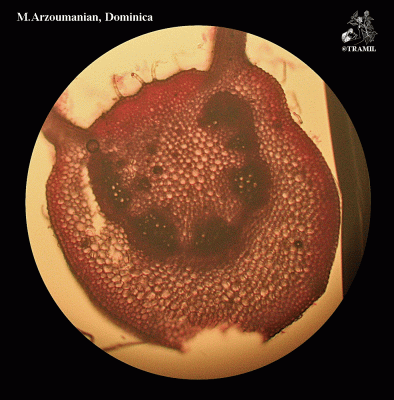
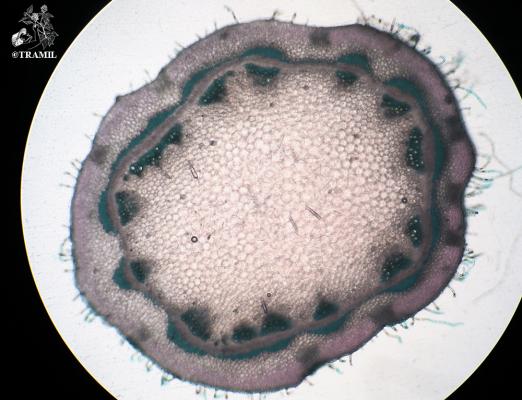
Petiveria alliacea
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Santo Domingo:
- anamú
Colombia:
- anamú
Panamá:
- anamú
Guatemala:
- apacín
Haití:
- ave
Honduras:
- ipacina
Dominica:
- koujourouk
Distribución geográfica
Originaria de América tropical, cultivada y naturalizada en regiones tropicales.
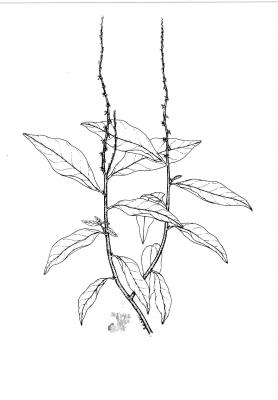
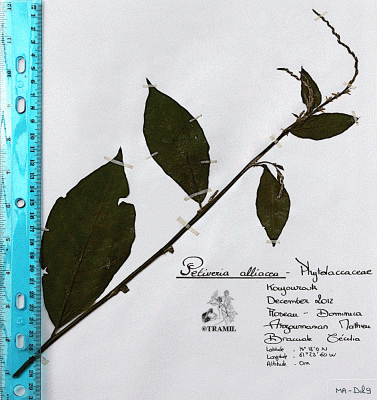
Descripción botánica
Herbácea o sufruticosa perenne de hasta 1 m de alto, de olor fétido. Hojas alternas, oblongas a elípticas, agudas a acuminadas en el ápice, generalmente glabras. Espigas de hasta 40 cm, pubérulas; flores perfectas, subsésiles, apétalas. Aquenio de alrededor de 8 mm de largo, cuneado, estriado, con seis cerdas terminales reflexas; semilla solitaria, linear.
Voucher(s)
Girón,184,CFEH
Gómez,140961,HUA
FLORPAN,1936,PMA
Jiménez,24,JBSD
Farmacopea
Ed.3References
1 GIRÓN L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
2 SOLÍS P, CORREA M, GUPTA M, 1995
Encuesta TRAMIL (Comunidades afro-caribeñas). Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
3 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
4 GÓMEZ H, GAITÁN R, DÍAZ F, 2003
Encuesta TRAMIL (Norte del departamento de Bolívar). Grupo de Productos Naturales, Facultad de Ciencias Químicas y Farmacéuticas. Universidad de Cartagena, Cartagena de Indias, Colombia.
5 Castillo D, RodrÍguez S, de los Santos C, BelÉn A, 2003
Encuesta TRAMIL (región Este). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, Rep. Dominicana.
6 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
7 CASTILLO D, RODRÍGUEZ S, DE LOS SANTOS C, BELÉN A, 2003
Encuesta TRAMIL (Zambrana, Cotuí). Dep. de Botánica, Jardin Botánico Nacional, Santo Domingo, Rep. Dominicana.
8 LEMUS Z, GARCÍA M, BATISTA A, DE LA GUARDIA O, CASTILLO A, 2004
La tableta de anamú: un medicamento herbario inmunoestimulante. MEDISAN 8(3), 57-64.
9 WENIGER B, SAVARY H, DAGUIHL R, 1984
Tri phytochimique de plantes de la liste TRAMIL. Laboratoire de chimie des substances naturelles, Faculté de Médecine et de Pharmacie, Université d'Etat d'Haïti, Port au Prince, Haïti.
10 HEGNAUER R, 1973
Chemotaxonomy der Pflanzen. Basel, Schweiz: Birkhauser Verlag. 6:882.
11 SEGELMAN F, SEGELMAN A, 1975
Constituents of Petiveria alliacea. Lloydia 38(6):537.
12 DE SOUSA JR, DEMUNER AJ, PINHEIRO JA, BREITMAIER E, CASSELS BK, 1990
Dibenzyl trisulphide and trans-N-methyl-4-methoxyproline from Petiveria alliacea. Phytochemistry 29(11):3653-3655.
13 BOUCOURT E, MARTÍNEZ M J, MOREJÓN Z, 2010
Evaluación de la actividad antimicrobiana del extracto acuoso de la raíz fresca de Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, C. Habana, Cuba.
14 FURONES JA, MORÓN F, PINEDO Z, 1996
Ausencia de la acción analgésica de la Petiveria alliacea (anamu) en ratones. Rev Cubana Planta Med 1(1):16-18.
15 DEL CARMEN RIVAS C, JIMENEZ M, AYALA L, CARILLO C, CABRERA Y, 1988
Actividad anti-inflamatoria y analgésica de Petiveria alliaceae. Informe TRAMIL. Centro de Investigación y Desarrollo de Medicamentos (CIDEM), La Habana, Cuba.
16 FURONES JA, MORÓN F, PINEDO Z, 1996
Ausencia de actividad antiinflamatoria del extracto acuoso liofilizado de Petiveria alliacea (anamú) en ratas. Informe TRAMIL. Rev Cubana Planta Med 1(2):34-37.
17 MARTÍNEZ MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, FUENTES V, MORÓN F, PINEDO Z, BOUCOURT E, 2001
Actividad antimicrobiana y sobre varias preparaciones de músculo liso, in vitro, de la decocción liofilizada de hoja de Petiveria alliacea. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
18 GARCÍA GM, COTO MT, GONZÁLEZ CS, PAZOS L, 1995
Velocidad del tránsito intestinal en ratones, del extracto acuoso de hoja fresca de Petiveria alliacea. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
19 ECHEVARRIA A, TORRES D, 2001
Efecto de un extracto de Petiveria alliacea Lin sobre el crecimiento de Giardia lamblia in vitro. Rev Cubana Med Mil 30(3):161-165.
20 CÁCERES A, GIRÓN LM, ALVARADO SR, TORRES MF, 1987
Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharm 20(3):223-237.
21 CÁCERES A, LÓPEZ BR, GIRÓN MA, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatophytic infections. 1. Screening for the antimicotic activity of 44 plant extracts. J Ethnopharm 31(3):263-276.
22 RUFFA MJ, PERUSINA M, ALFONSO V, WAGNER ML, SURIANO M, VICENTE C, CAMPOS R, CAVALLARO L, 2002
Antiviral activity of Petiveria alliacea against the bovine viral diarrhea virus. Chemotherapy 48(3):144-147.
23 CÁCERES A, JAUREGUI E, HERRERA D, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatomucosal infections. 1: Screening of 38 plant extracts for anticandidal activity. J Ethnopharm 33(3):277-283.
24 GERMANO DH, CALDEIRA TT, MAZELLA AA, SERTIE JA, BACCHI EM, 1993
Topical anti-inflammatory activity and toxicity of Petiveria alliacea. Fitoterapia 64(5):459-467.
25 ANDERSSON DUNSTAN C, NOREEN Y, SERRANO G, COX PA, PERERA P, BOHLIN L, 1997
Evaluation of some Samoan and Peruvian medicinal plants by prostaglandin biosynthesis and rat ear oedema assays. J Ethnopharmacol 57(1):35-56.
26 LIMA TCM, MORATO GS, TAKAHASHI RN, 1991
Evaluation of antinociceptive effect of Petiveria alliacea (guiné) in animals. Mem Inst Oswaldo Cruz 86(suppl.2):153-158.
27 FERRAZ MB, PEREIRA RB, IWATA NM, ATRA E, 1991
Tipi. A popular analgesic tea. A double blind cross-over trial in osteoarthritis. Clin Exp Rheumatol 9(2):205-206.
28 GARCÍA GM, COTO MT, GONZÁLEZ CS, PAZOS L, 1996
Toxicidad sub-crónica en ratones, del extracto acuoso de hojas frescas de Petiveria alliacea. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
29 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, MORÓN F, 2001
Toxicidad aguda (DL50) oral de la decocción de hojas jóvenes frescas de Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”. C. La Habana, Cuba.
30 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, 2001
Toxicidad aguda (DL50) intraperitoneal de la decocción liofilizada de hojas frescas de Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”. C. La Habana, Cuba.
31 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, 2001
Genotoxicidad in vivo: ensayo de morfología de la cabeza del espermatozoide en ratones de decocción liofilizada de hojas frescas de Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”, C. La Habana, Cuba.
32 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V. 2001
Genotoxicidad in vivo: ensayo de micronúcleos en médula ósea de decocción liofilizada de hoja fresca de Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”, C. La Habana, Cuba.
33 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, 2001
Genotoxicidad in vitro: mediante el sistema de ensayo con Aspergillus nidulans de decocción liofilizada de hoja fresca Petiveria alliacea L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”, C. La Habana, Cuba.
34 CÁCERES A, LÓPEZ B, GONZÁLEZ S, BERGER I, TADA I, MAKI J, 1998
Plants used in Guatemala for the treatment of protozoal infections. I. Screening of activity to bacteria, fungi and American trypanosomes of 13 native plants. J of Ethnopharmacology 62(3):195-202.
35 GUERRA MO, OLIVEIRA AB, MAIA JGS, PETERS VM, 1989
Alteraçäo do desenvolvimento embrionário de ratos após tratamento com extratos aquosos de diferentes orgäos de Petiveria alliacea. Bol Centro Biol Reprod 8:17-22.
36 GERMANO DHP, SERTIE JAA, BACCHI EM, 1995
Pharmacological assay of Petiveria alliacea. II. Oral anti-inflammatory activity and gastrotoxicity of a hydroalcoholic root extract. Fitoterapia 66(3):195-202.
37 REYNOLDS J Ed., 1996
Martindale: The extra pharmacopoeia. Evaluated information on the world’s drugs and medicines. 31st ed. London, England: The Royal Pharmaceutical Society. p1678.
38 BUDAVARI S Ed., 2001
The Merck Index: an encyclopedia of chemical, drugs, and biologicals. 30th ed. Whitehouse Station, USA: Merck & Co., Inc. p181.
39 ALBORNOZ A, 1993
Medicina tradicional herbaria. Caracas, Venezuela: Editorial Instituto Farmacoterápico Latino S.A. p298.