Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Cuba:
- caisimón de anís
Distribución geográfica
Nativa del sureste de México y Centroamérica, cultivada y naturalizada en Cuba y Florida.
Descripción botánica
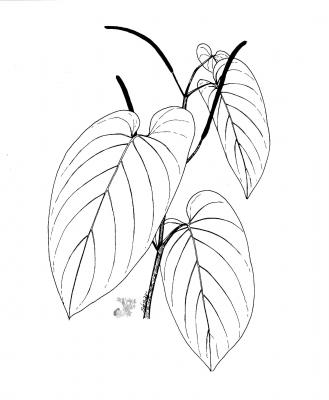
Arbusto de 2 a 3 m, aromático, de madera suave. Hojas ovadas u oblongo-ovadas de hasta 60 cm de largo, agudas a corto acuminadas en el ápice, cordadas en la base, lóbulos basales redondeados, marcadamente desiguales. Espigas de color verde pálido, de 10 a 20 cm de largo; brácteas redondeadas y densamente ciliadas. Frutos pequeños agrupados en las espigas.
Voucher(s)
Fuentes,4749,ROIG
Farmacopea
Ed.3References
1 MOREJÓN Z, LÓPEZ M, GARCÍA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORÓN F, BOULOGNE I, GERMOSÉN-ROBINEAU L, 2009
Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la ciudad de La Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, La Habana, Cuba.
2 PINEDA R, VIZCAINO S, GARCÍA CM, GIL JH, DURANGO DL, 2012
Chemical composition and antifungal activity of Piper auritum Kunth and Piper holtonii C. DC. against phytopathogenic fungi. Chilean JAR 74:507-515.
3 HANSEL R, LEUSCHKE A, 1975
Aporphine-type alkaloids from Piper auritum. Lloydia 38(6):529-530.
4 DOMINGUEZ XA, ROJAS P, GARZA MDR, CORDOVA JA, 1962
Preliminary study of 25 plants from the central territory of Quintana Roo, Mexico. Rev Soc Quim Mex 6:213-215.
5 OSCAR CC, POVEDA ALJ, 1983
Piper auritum (H.B.K.), Piperaceae family. Preliminary study of the essential oil from its leaves. Ing Cienc Quim 7(1-2):24-25.
6 GUPTA M, 1987
Essential oil: a new source of bee repellents. Chem Ind (London) 5:161-163.
7 MONZOTE L, GARCÍA M, MONTALVO AM, SCULL R, MIRANDA M, 2010
Chemistry, cytotoxicity and antileishmanial activity of the essential oil from Piper auritum. Mem Inst Oswaldo Cruz 105(2):168-173.
8 AMPOFO SA, ROUSSIS V, WIEMER DF, 1987
New prenylated phenolics from Piper auritum. Phytochemistry 26(8):2367-2370.
9 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press, p130.
10 MARTÍNEZ I, DUMENIGO A, BRITO G, MORÓN F, 2013
Actividad antiinflamatoria tópica de zumo de hojas frescas de Piper auritum Kunth en en edema de oreja inducido por aceite de Croton en ratones. Trabajo TRAMIL. Laboratorio Central de Farmacología, Facultad de C. Médicas Dr. Salvador Allende, La Habana, Cuba.
11 VEGA MONTALVO R, LAGARTO PARRA A, 1999
Evaluación del efecto antiinflamatorio del extracto de Piper auritum HBK y toxicidad aguda oral. Rev cuba plant med 4(1):11-14.
12 GUERRA MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, 2001
Genotoxicidad in vitro: mediante el sistema de ensayo con Aspergillus nidulans de decocción liofilizada de hojas frescas de Piper auritum. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina Dr. Salvador Allende, La Habana, Cuba.
13 BETANCOURT J, MARTINEZ MJ, LÓPEZ M, MOREJÓN Z, BOUCOURT E, MORÓN F, 2000
Actividad genotóxica in vivo de hoja seca de Piper auritum H.B.K. en el test de micronúcleos de medula ósea de ratón. Informe TRAMIL. Laboratorio Central de Farmacología, Fac. C. Médicas “Dr. S. Allende”, La Habana, Cuba.
14 GARCÍA GM, COTO MT, GONZÁLEZ CS, PAZOS L, 2000
Toxicidad aguda en ratones, del extracto acuoso de hojas frescas de Piper auritum. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
15 GUERRA MJ, LÓPEZ M, BOUCOURT E, FUENTES V, 2002
Toxicidad aguda (DL50) de la decocción liofilizada de hojas frescas de Piper auritum. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina Dr. Salvador Allende. La Habana, Cuba.
16 GUERRA MJ, LÓPEZ M, BOUCOURT E, FUENTES V, 2002
Toxicidad aguda (DL50) del extracto hidroalcohólico (45%) de hojas secas de Piper auritum. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina Dr. Salvador Allende. La Habana, Cuba.
17 GUERRA MJ, LÓPEZ M, BOUCOURT E, FUENTES V, MORÓN F, 2002
Clases tóxicas agudas de extracto hidroalcohólico (30%) de hojas secas de Piper auritum. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina Dr. Salvador Allende. La Habana, Cuba.
18 LÓPEZ M, MOREJÓN Z, GARCÍA A, BACALLAO Y, 2012
Ausencia de irritabilidad dérmica aguda de la decocción 50% de hojas frescas de Piper auritum Kunth en piel sana y dañada en conejos. Trabajo TRAMIL. Laboratorio Central de Farmacología, Facultad de C. Médicas Dr. Salvador Allende, La Habana, Cuba.
19 LÓPEZ M, MOREJÓN Z, GARCÍA A, BACALLAO Y, 2012
Ausencia de irritabilidad dérmica aguda de hojas frescas calentadas de Piper auritum Kunth en piel sana y dañada en conejos. Trabajo TRAMIL. Laboratorio Central de Farmacología, Facultad de C. Médicas Dr. Salvador Allende, La Habana, Cuba.
20 PILOTO FERRER J, VIZOSO A, RAMOS A, GARCÍA A, REMIGIO A, VEGA Y, GONZÁLEZ ML, RODRÍGUEZ C, CARBALLO C, 2009
Plantas medicinales. Diez años de evaluaciones toxicogenéticas en el CIDEM. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 8(5):428-434.
21 PARRA AL, YHEBRA RS, SARDINAS IG, BUELA LI, 2001
Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
22 NATIONAL TOXICOLOGY PROGRAM, 2011
Safrole CAS Nº 94-59-7. Report on Carcinogens, Twelfth Edition. National Toxicology Program, Department of Health and Human Services. p. 374-375 En: http://ntp.niehs.nih.gov/go/roc12
23 DUKE J. 2013
Plants Containing SAFROLE Dr. Duke's Phytochemical and Ethnobotanical Databases. En: www.ars-grin.gov/cgi-bin/duke/highchem.pl (1 of 2) 23/01/2013
24 FISHER SCIENTIFIC AB, 2006
Safety data sheet safrol. From registry of toxic effects of chemical substances (RTECS). The Condensed Chemical Dictionary, Hawley, 11th. Edition and Handbook of Poisoning, R.E.Dreisbach, 12th edition.