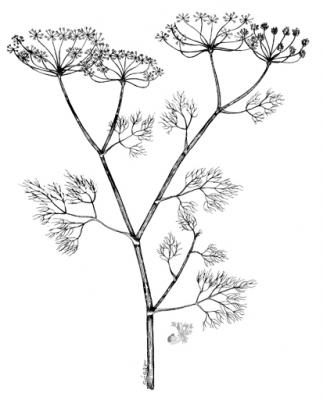
Anethum graveolens
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Martinica:
- anis
- ianni
Santo Domingo:
- hinojo
Distribución geográfica
Originaria del Mediterráneo, cultivada ampliamente en América.
Descripción botánica
Planta herbácea erguida de hasta 1.7 m de alto, glabra y glauca. Hojas alternas, oblongas a obovadas de hasta 35 cm, tripinnadas con los últimos segmentos filiformes; vainas peciolares de 1-3 cm de longitud. Inflorescencias con umbelas terminales y laterales; flores numerosas de pétalos amarillos. Fruto ovado-elíptico, glabro, de hasta 4 mm de longitud, compreso dorsalmente, costillas estrechamente aladas, las 2 laterales más amplias.
Con frecuencia esta especie es confundida con Foeniculum vulgare, el cual tiene una vaina peciolar más larga y todas las costillas del fruto son iguales.
Voucher(s)
Arvigo,1064,JBSD
Fuentes,4644,ROIG
Longuefosse&Nossin,108,HAVPM
Farmacopea
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 LONGUEFOSSE JL, NOSSIN E, 1990-95
Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
3 DANIEL M, 1989
Polyphenols of some Indian vegetables. Curr Sci 58(23):1332-1334.
4 VARNAITE R, 1988
Rutin content in capsicum, capsella, urtica, primula, lepidium, lactuca, brassica, anethum, beta, petroselinum, Allium genera representatives. Liet Tsr Mokslu Akad Darb Ser C 4:29-32.
5 DRANIK LI, PROKOPENKO AP, 1969
Coumarins and acids from Anethum graveolens fruit. Khim Prir Soedin 55:437.
6 APLIN RT, PAGE CB, 1967
Constituents of native Umbelliferae. I. Coumarins from dill (Anethum graveolens). J Chem Soc C 23:2593-2596.
7 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p17.
8 HOSSEINZADEH H, KARIMI GR, AMERI M, 2002
Effects of Anethum graveolens L. seed extracts on experimental gastric irritation models in mice. BMC Pharmacol 2:21.
9 IKRAM M, HAQ I, 1980
Screening of medicinal plants for antimicrobial activity. Fitoterapia 51:281-284.
10 SHIPOCHLIEV T, 1968
Pharmacological investigations into several essential oils, first communication. Effect on the smooth musculature. Vet Med Nauki 5(6):63-69.
11 HARRIES N, JAMES KC, PUGH WK, 1978
Antifoaming and carminative actions of volatile oils. J Clin Pharmacol 2:171-177.
12 DUKE JA, 1992
Handbook of biologicaly active phytochemicals and their activities. Boca Raton, USA: CRC Press.
13 PDR for Herbal Medicines, 2000
Anethum graveolens. Physician Desk Reference (PDR) for Herbal Medicines, Montvale, USA: Medical Economics Company. p252.
14 CANIGUERAL S, VILA R, RISCO E, PÉREZ F, PORTILLO A, FREIXA B, MILO B, VANACLOCHA B, RIOS JL, MORALES MA, ALONSO JR, BACHILLER LI, PERIS JB, STUBING G, 2002
Anethum graveolens. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Jul.20,2002. URL: http://www.masson.es/book/fitoterapia.html
15 MARTÍNEZ MJ, BETANCOURT J, LÓPEZ M, MOREJÓN Z, BARCELÓ H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORÓN F, 2000
Toxicidad aguda clásica y clases tóxicas agudas de semilla seca de Anethum graveolens. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
16 NATAQUE K, KANZAWA K, MIZUNO M, UENO N, KOBAYASHI T, DANNE GI, MINAMOTO S, 1989
Herb water-extracts markedly suppress the mutagenicity of TRP-P-2. Agr Biol Chem 53(5):1423-1425.
17 NATH D, SETHI N, SINGH RK, JAIN AK, 1992
Commonly used Indian abortifacient plants with special reference to their teratologic effects in rats. J Ethnopharmacol 36(2):147-154.
18 SETHI N, NATH D, SINGH RK, 1989
Teratological evaluation of some commonly used indigenous antifertility plants in rats. Int J Crude Drugs Res 27(2):118-120.
19 FUKUOKA M, YOSHIHIRA K, NATORI S, SAKAMOTO K, IWAHARA S, HOSAKA S, IRONO I, 1980
Characterization of mutagenic principle and carcinogenicity test of dill weed and seeds. J Pharmacobio Dyn 3(5):236-244.
20 ALBORNOZ A, 1993
Medicina tradicional herbaria. Guía de Fitoterapia. Caracas, Venezuela: Editorial Instituto Farmacoterápico Latino S.A. pp87,122.