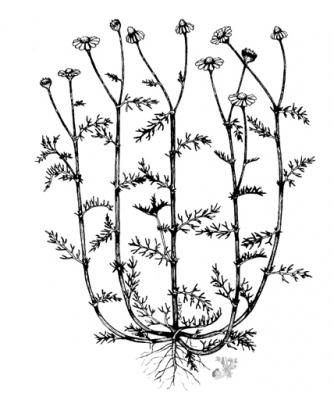
Matricaria recutita
Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Colombie:
- manzanilla
Honduras:
- manzanilla
Guatemala:
- manzanilla
Distribution géographique
Originaire d’Europe et d’Asie, cultivée dans toute l’Amérique.
Description botanique
Herbacée annuelle, dressée, très ramifiée pouvant atteindre 60 cm. Feuilles paripennées, à segments linéaires. Capitules floraux de 2,5 cm de diamètre, sur pédoncules terminaux courts; ligules blanches, sans bords. Akènes avec 3 à 5 côtes, peu apparentes.
Il existe d’importants problèmes de nomenclature en ce qui concerne le genre, et de nombreux synonymes pour l’espèce1.
Voucher(s)
Girón,230,CFEH
Ochoa,317,HPMHV
Ríos,315,CECALLI
Pharmacopée
Ed.3References
1 RAUSCHERT S, 1974
Nomenklatorische Probleme in der Gattung Matricaria L.
Folia Geobot Phytotax Praha 9:249-260.
2 LAGOS-WITTE S, 1988-89, 1996
Encuesta TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Dep. de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
3 GOMEZ H, GAITAN R, DIAZ F, 2003
Encuesta TRAMIL (Norte del departamento de Bolívar). Grupo de Productos Naturales, Facultad de Ciencias Químicas y Farmacéuticas. Universidad de Cartagena, Cartagena de Indias, Colombia.
4 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
5 FRANZ C, WICKEL I, 1980
Contribution to the heredity of bisaboloids in Chamomilla recutita. (abstract). Planta Med 39:287-288.
6 SALAMON I, 1992
Production of chamomile, Chamomilla recutita (L.) Rauschert, in Slovakia. J Herbs Spices Med Plants 1(1/2):37-45.
7 MANCHENO MN, 1987
La manzanilla dentro del plan terapéutico de tratamiento de la enfermedad diarreica aguda del Ministerio de Salud. Nicaragua. Rescate de la Medicina Popular Tradicional.
8 MERICLI AH, 1990
The lypophilic compounds of a Turkish Matricaria chamomilla variety with no chamazulene in the volatile oil. Int J Crude Drug Res 28(2):145-147.
9 TOPOLOV V, GABROLOV M, YANKOLOV J, 1983
Plantas medicinales and fitoterapia (Bilki and Bilcosvirane). Plovdiv, Bulgaria: Ed. Jristo G. Danov.
10 MORON F, FURONES J, PINEDO Z, 1996
Actividad espasmolítica del extracto fluído de Matricaria recutita (Manzanilla) en órganos aislados. Rev Cubana Plant Med 1(1):19-24.
11 GARCIA-GONZÁLEZ M, BOLAÑOS AN, ARGUEDAS CR, 2005
Efecto analgésico en ratas, por vía oral, del extracto acuoso (decocción) de la planta entera sin flor de Matricaria recutita dosis única. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
12 GARCIA-GONZÁLEZ M, ARGUEDAS R, y FERNANDEZ A, 2005
Efecto antiinflamatorio en ratas, por vía oral, del extracto acuoso (decocción) de la planta entera sin flor de Matricaria recutita dosis única. Informe TRAMIL. PRONAPLAMED. Depto de Fisiología, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
13 ABDUL-GHANI AS, EL-LATI SG, SACAAN AI, SULEIMAN MS, AMIN RM, 1987
Anticonvulsant effects of some Arab medicinal plants. Int J Crude Drug Res 25(1):39-43.
14 HOERHAMMER L, 1962
Flavone concentration of medicinal plants with regard to their spasmolytic action. Congr Sci Farm Conf Commun 21st Pisa 1961(21):578-588.
15 JAKOVLEV V, ISAAC O, FLASKAMP E, 1983
Pharmakologische Untersuchungen von Kamillen-Inhaltsstoffen. VI. Untersuchungen zur antiphlogistichen Wirkung von Chamazulen und Matricin. Planta Med 49(10):67-73.
16 YAMAZAKI M, SHIROTA H, 1981
Application of experimental stress ulcer test in mice for the survey of neurotropic naturally occurring drug materials. Shoyakugaku Zasshi 35:96-102.
17 GERSHEBIN LL, 1977
Regeneration of rat liver in the presence of essential oils and their components. Food Cosmet Toxicol 15(3):173-182.
18 ITOKAWA H, MIHASHI S, WATANABE K, NATSUMOTO H, HAMANAKA T, 1983
Studies on the constituents of crude drugs having inhibitory activity against contraction of the ileum caused by histamine or barium chloride (I). Screening test for the activity of commercially available crude drugs and the related plant materials. Shoyakugaku Zasshi 37(3):223-228.
19 LESLIE GB, 1978
A pharmacometric evaluation of nine bio-strath herbal remedies. Medita 8(10):3-19.
20 SZELENYI I, ISAAC O, THIEMER K, 1979
Pharmakologische Untersuchungen von Kamillen-inhaltsstoffen. III. Tierexperimentelle Untersuchungen über die ulkusprotektive Wirkung der Kamille. Planta Med 35(3):218-227.
21 SHIPOCHLIEV T, 1981
Uterotonic action of extract from a group of medicinal plants. Vett Med Nauki 18(4):94-98.
22 AGGAG ME, YOUSEF RT, 1972
Study of antimicrobial activity of chamomile oil. Planta Med 22(2):140-144.
23 MANN C, STABA E, 1986
The chemistry, pharmacology and commercial formulations of chamomile. In: Herbs, spices and medicinal plants; recent advances in botany, horticulture and pharmacology. Phoenix, USA: Oryxpress 1:235-280.
24 ISAAC O, 1979
Pharmacological investigations with compounds of chamomile I. On the pharmacology of alpha-bisabolol and bisabolol oxides (review). Planta Med 35(2):118-124.
25 ACHTERRATH-TUCKERMANN U, KUNDE R, FLASKAMP E, ISAAC O, THIEMER K, 1980
Pharmacological investigations with compounds of chamomile. V. Investigations on the spasmolytic effect of compounds of chamomile and Kamillosan on the isolated guinea pig ileum. Planta Med 39(1):38-50.
26 MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, MORON F, 2005
Clases tóxicas agudas (CTA) de decocción de flor seca de Matricaria recutita L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
27 JAKOVLEV V, SCHLICHTEGROLL A, 1969
Antiinflammatory activity of (-)-alpha-bisabolol, an essential component of chamomille oil. Arzneim-Forsch 19:615.
28 AL-HINDAWI M, AL-DEEN I, NABI M, ISMAIL M, 1989
Antiinflamatory activity of some Iraqi plants using intact rats. J Ethnopharmacol 26(2):163-168.
29 LESLIE G, SALMON G, 1979
Repeated dose toxicity studies and reproductive studies on nine bio-strath herbal remedies. Swiss Med 1(1/2):1-3.
30 VIZOSO A, RAMOS A, VILLAESCUSA A, DEDALO M, BETANCOUR J, 2000
Evaluación del efecto genotóxico en extractos fluidos de Plantago lanceolata L., (llantén menor) y Matricaria chamomilla L. (manzanilla). Revista cubana de plantas medicinales 5(2):59-63.
31 BENNER MH, LEE HJ, 1973
Anaphylactic reaction to chamomille tea. J Allergy Clin Immunol 52(5):307-308.
32 LEWIS R, TATKEN R, (Eds.), 1980
Registry of toxic effects of chemical substances. Vol. 1. Cincinnati, USA: Nat. Instit. Occupational Health.
33 ANON (Select Committee on GRAS Substances), 1976
GRAS status of foods and food additives. Washington, USA: Food and Drug Administration, Department of Health and Human Services, Office of the Federal Register National Archives and Records Administration 41, 38644.