Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Haïti:
- asorosi
Honduras:
- calaica
Barbade:
- cerasee
Trinité-et-Tobago:
- corailee
- popololo
- sorrow seed
Porto Rico:
- cundeamor
République dominicaine:
- cundeamor
Vénézuéla:
- cundeamor
Dominique:
- kokouli
Antigua-et-Barbuda:
- maiden blush
Costa Rica:
- sorosí
Guatemala:
- sorosí
Autres noms vernaculaires
Haïti:
- Asorosi
- Asorosi/cundeamor
- Asosi
- Yesken
Colombie:
- Balsamina
Honduras:
- Calaica
Barbade:
- Cerasee
Trinité-et-Tobago:
- Corailee = sorrow seed = popololo
République dominicaine:
- Cuandiamor
- Cuendeamor
- Cundeamor
Porto Rico:
- Cundeamor
Cuba:
- Cundeamor
Dominique:
- Kokouli
- Maiden apple cocouli
- Maiden's apple o pomme cooli
Antigua-et-Barbuda:
- Maiden Blush
Guadeloupe:
- Paroka
Belize:
- Sorosi
Costa Rica:
- Sorosi
Guatemala:
- Sorosí
Distribution géographique
Originaire de l’Ancien Monde et naturalisée sous tous les tropiques.
Description botanique
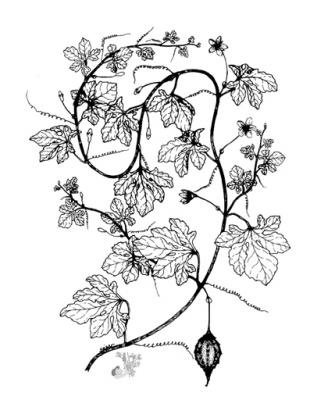
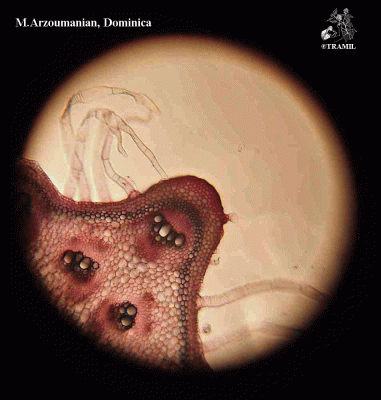
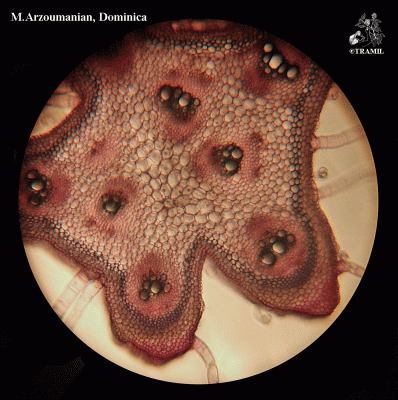
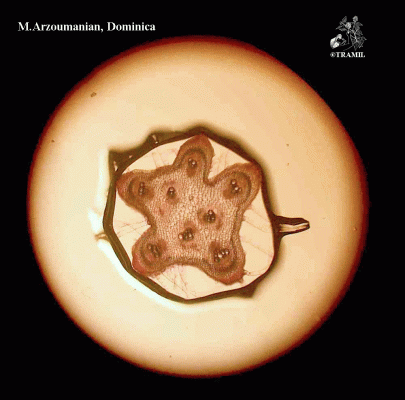
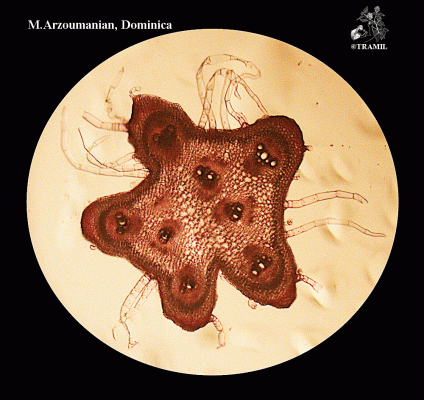
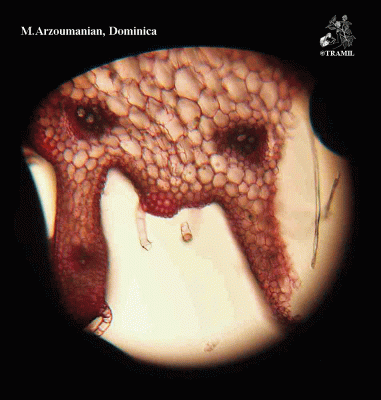
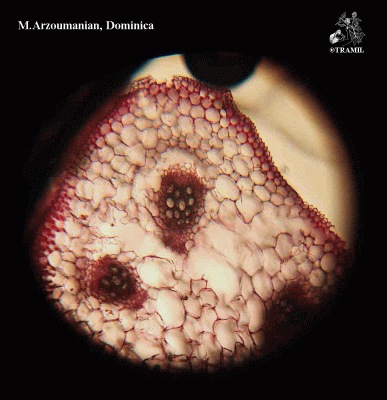
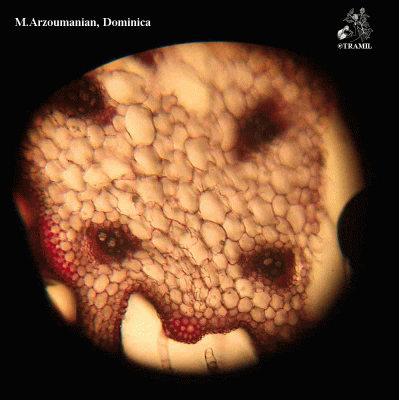
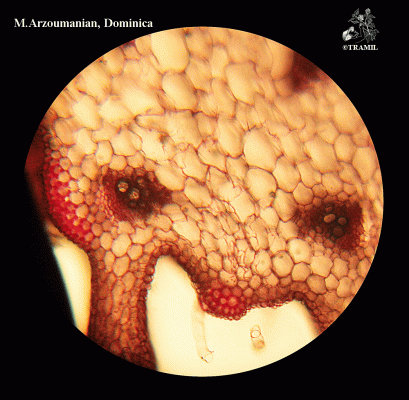
Herbe grimpante pouvant atteindre 6 m, habituellement très ramifiée. Feuilles alternes de 4 à 12 cm, avec 5-7 lobes; lobes obtus ou mucronés, bords dentés ou crénelés. Corolle jaune, segments obtus ou émargés de 1,5 à 2 cm. Fruit ellipsoïdal, tuberculé, déhiscent, de 5 à 15 cm de diamètre, jaune à orangé, avec 3 valves; pulpe de couleur rouge; graines ellipsoïdales, aplaties, de 10 à 16 mm.
Voucher(s)
Faujour,3,BAR
Pimentel,1111,JBSD
García,2329,JBSD
Girón,167,CGEH
Delens,105,VEN
Lagos-Witte,7,HPMHV
Fonrose,52,SOE
Mejía,s/n,MAPR
Delaigue,19,NHTT
Pharmacopée
Ed.3References
1 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
2 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
3 LAGOS-WITTE S, 1988-1995
Encuestas TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
4 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
5 WENIGER B, 1987-88
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
6 CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003
Encuesta TRAMIL (Zambrana, Cotuí). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
7 CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003
Encuesta TRAMIL (region Este). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
8 DELENS M, 1990
Encuesta TRAMIL en Barlovento, Edo. Miranda de Venezuela. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
9 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala.
10 DELAIGUE J, 2005
TRAMIL survey. UAG & PRDI, Tobago House of Assembly, Scarborough, Tobago.
11 O'REILLY A, 1992
TRAMIL survey. Chemistry & Food Technology Division, Ministry of Agriculture, Dunbars, Antigua & Barbuda.
12 OCAMPO R, 1988
Encuesta TRAMIL (Costa atlántica), Instituto de Desarrollo Agrario, Universidad de Costa Rica, San José, Costa Rica.
13 FAUJOUR A, MURREY D, CHELTENHAM-CORBIN B, CARRINGTON S, 2003
TRAMIL survey. IICA & UAG, Saint Thomas, Barbados.
14 BENEDETTI MD, 1994
Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
15 WENIGER B, SAVARY H, DAGUIHL R, 1984
Tri phytochimique de plantes de la liste TRAMIL. Laboratoire de chimie des substances naturelles, Faculté de médecine et de pharmacie, Université d'Etat d'Haïti, Port au Prince, Haïti.
16 HERRERA J, 1990
Determinación de actividades biológicas de vegetales utilizados en medicina tradicional. Informe TRAMIL. Dep. de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
17 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p110.
18 YASUDA M, IWAMOTO M, OKABE H, YAMAUCHI T, 1984
Structures of momordicines I, II and III, the bitter principles in the leaves and vines of Momordica charantia. Chem Pharm Bull 32(5):2044-2047.
19 DHALLA NS, GUPTA KC, SASTRY MS, MALHOTRA CL, 1961
Chemical composition of the fruit of Momordica charantia. Indian J Pharmacy 23:128-130.
20 KANNA B, 1976
Insulin from Momordica charantia. Patent-Japan Kokai.
21 NG TB, YEUNG HW, 1984
Bioactive constituents of Cucurbitaceae plants with special emphasis on Momordica charantia and Trichosanthes kirilowii. Seoul, Korea: Proc. 5th. Symposium Medicinal Plants and Spices.
22 KHANNA P, MOHAN S, 1973
Isolation and identification of diosgenin and sterols from fruits and in vitro cultures of Momordica charantia. Indian J Exp Biol 11:58-60.
23 OKABE H, MIYAHARA K, YAMAGUCHI T, MIYAHARA K, KAWASAKI T, 1980
Studies on the constituents of Momordica charantia L. I: Isolation and characterization of momordicosides A and B, glycosides of a pentahydroxy-cucurbitane triterpene. Chem Pharm Bull 28(9):2753-2762.
24 RODRIGUEZ DB, RAYMUNDO LC, TUNG-CHING LEE, SIMPSON KL, CHICHESTER CO, 1976
Carotenoid pigment changes in ripening Momordica charantia fruits. Ann Bot (London) 40(3):615-624.
25 CACERES A, JAUREGUI E, HERRERA D, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatomucosal infections. 1: Screening of 38 plant extracts for anticandidal activity. J Ethnopharmacol 33(3):277-283.
26 HEAL R, ROGERS E, WALLACE RT, STARNES O, 1950
A survey of plants for insecticidal activity. Lloydia 13(2):89-162.
27 HUSSAIN HSN, DEENI YY, 1991
Plants in Kano ethnomedicine; screening for antimicrobial activity and alkaloids. Int J Pharmacol 29(1):51-56.
28 MANEELRT S, SATTHAMPONGSA A, 1978
Antimicrobial activity of Momordica charantia. Undergraduate special project report. Bangkok, Thailand: Mahidol University. Faculty of Pharmacy.
29 MOKKHASMIT M, SAWASDIMONGKOL K, SATRAWAHA P, 1971
Study on toxicity of Thai medicinal plants. Bull Dept Med Sci 12(1/2):36-65.
30 GONZALEZ A, ALFONSO H, 1990
Evaluación de la toxicidad dérmica de Momordica charantia L., Foeniculum vulgare Mill y Cassia occidentalis L. en cobayos. Informe TRAMIL. Centro Nacional de Salud Animal, La Habana, Cuba.
31 GONZALEZ A, ALFONSO H, 1990
Evaluación de la toxicidad dérmica de Momordica charantia L. y Cassia occidentalis L. en conejos. Informe TRAMIL. Centro Nacional de Salud Animal, La Habana, Cuba.
32 LAGARTO A, COURET M, GUERRA I, LOPEZ R, 2008
Toxicidad aguda oral y ensayos de irritación de extractos acuoso e hidroalcohólico de (follaje) Momordica charantia L. Rev Cubana Plant Med [online] 13(3):0-0. Disponible en: http://bvs.sld.cu/revistas/pla/vol13_3_08/pla05308.htm
33 TABORA O, 1986
Estudio de toxicidad aguda en ratones de la fracción hipoglucemiante de Momordica charantia (Cucurbitaceae). Tegucigalpa, Honduras: IV Semana Científica Universidad Nacional Autónoma de Honduras UNAH.
34 PRAKASH AO, MATHUR R, 1976
Screening of Indian plants for antifertility activity. Indian J Exp Biol 14(5):623-626.
35 RUIZ AR, DE LA TORRE RA, ALONSO N, VILLAESCUSA A, BETANCOURT J, VIZOSO A, 1996
Screening of medicinal plants for induction of somatic segregation activity in Aspergillus nidulans. J Ethnopharmacol 52(3):123-127.
36 SHARMA VN, SOGANI RK, ARORA RB, 1960
Some observations on hypoglycemic activity of Momordica charantia. Indian J Med Res 48(4):471-477.
37 UCHE-NWACHI EO, MC EWEN C, 2010
Teratogenic effect of the water extract of bitter gourd (Momordica charantia) on the Sprague Dawley rats. African J of Traditional, Complementary and Alternative Medicines 7(1):24-33.
38 DIXIT VP, KHANNA P, BHARGAVA SK, 1978
Effects of Momordica charantia fruit extract on the testicular function of dog. Planta Med 34(3):280-286.
39 KOENTJORO-SOEHADI T, SANTA I, 1982
Perspectives of male contraception with regards to Indonesian traditional drugs. Bali, Indonesia: 2nd National Congress of Indonesian Society of Andrology.
40 KHAN AH, BURNEY A, 1962
A preliminary study of the hypoglycemic properties of indigenous plants. Pakistan J Med Res 2:100-116.
41 WEST M, SIDRAK G, STREET S, 1971
The anti-growth properties of extracts from Momordica charantia. West Indian Med J 20(1):25-34.
42 NG T, 1988
Effects of momorcharins on ovarian response to gonadotropin induced superovulation in mice. Int J Fertil 33(2):123-128.
43 YEUNG HW, LI WW, FENG Z, BARBIERI L, STIRPE F, 1988
Trichosanthin, alpha-momorcharin and beta-momorcharin: Identity of abortifacient and ribosome-inactivating protein. Int J Peptide Protein Res 31(3):265-268.