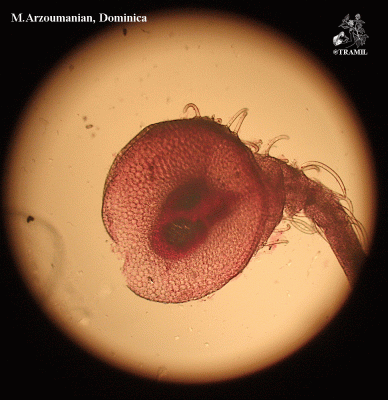
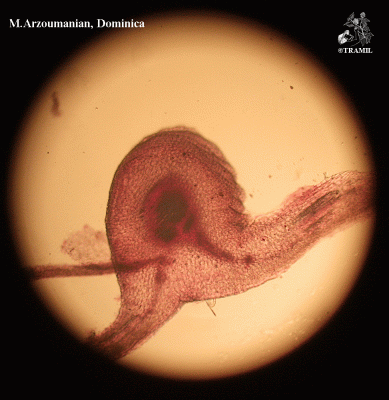
Senna occidentalis
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Santo Domingo:
- brusca
Dominica:
- café moucha
Guatemala:
- frijolillo
Honduras:
- frijolillo
Haití:
- terrier rouge
Distribución geográfica
Pantropical y subtropical.
Descripción botánica
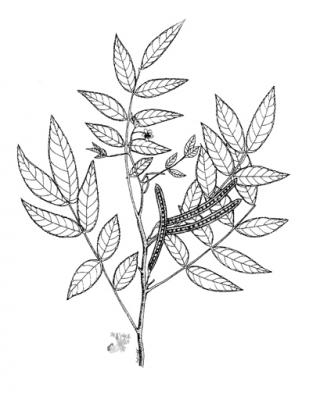
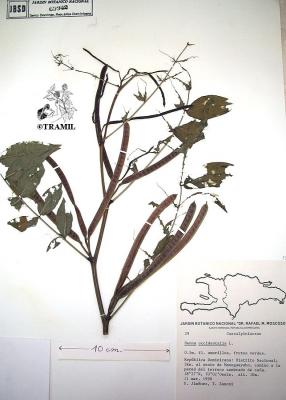
Herbácea de hasta 2 m de altura, finamente estrigulosa. Hojas alternas, pinnadas, arregladas espiralmente; folíolos en 3 a 6 pares, ovados a lanceolados, agudos a acuminados; pecíolo con glándula en la base, sésil, globosa o cónica; estípulas linear-lanceoladas a triangular, acuminadas, caducas. Racimos axilares con flores amarillas; sépalos oblongos, obtusos; pétalos ovados o elípticos. Vaina linear, obtusa, mucronata, erecta, más o menos arqueada, con numerosas semillas ovoides.
Voucher(s)
Jiménez,29&116,JBSD
Lagos-Witte,16,HPMHV
Girón,249,CFEH
Rouzier,225,SOE
Farmacopea
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
3 LAGOS-WITTE S, 1988-89, 1996
Encuesta TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
4 GIRÓN L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
5 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
6 TIWARI RD, SINGH J, 1977
Anthraquinone pigments from Cassia occidentalis. Planta Med Suppl 32(4):375-377.
7 RAI PP, SHOK M, 1983
Anthraquinone glycosides from plant parts of Cassia occidentalis. Indian J Pharm Sci 45(2):87-88.
8 ANTON R, DUQUENOIS P, 1968
Contribution à l'étude chimique du Cassia occidentalis L. Annales Pharmaceutiques Françaises 26(2):673-680.
9 TIWARI RD, SINGH J, 1977
Flavonoids from the leaves of Cassia occidentalis. Phytochemistry 16(7):1107-1108.
10 MAJUMDAR SG, BASAK B, LASKAR S, 1987
Surface hydrocarbons from the leaves of some Cassia species. J Indian Chem Soc 64(4):259-260.
11 ALVES AC, 1964
Pharmacological study of the root of Cassia occidentalis. An Fac Farm Porto 24:65-119.
12 WADER GR, KUDAV NA, 1987
Chemical investigation of Cassia occidentalis Linn. with special reference to isolation of xanthones from Cassia spp. Indian J of Chemisitry 26(B7):703.
13 KUDAV NA, KULKARNI A,B 1974
Chemical investigation on Cassia occidentalis. II. Isolation of islandicin, helminthosporine, xanthonin and NMR spectral studies of cassiollin and its derivatives. Indian J Chem 12:1042-1044.
14 LAL-JAWAHAR, GUPTA-PURAN-CHANDRA, 1973
Physcion and phytosterol from the roots of Cassia occidentalis. Phytochemistry 12(5):1186.
15 GARCÍA GM, COTO MT, GONZÁLEZ CS, OCAMPO R, PAZOS L, 2001
Tránsito intestinal en ratones, con extracto acuoso de raíz fresca de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
16 CÁCERES A, LÓPEZ BR, GIRÓN MA, LOGEMANN H, 1991
Plants used in Guatemala for the treatment of dermatophytic infections. 1. Screening for antimycotic activity of 44 plant extracts. J Ethnopharmacol 31(3):263-276.
17 CÁCERES A, MENENDEZ H, MÉNDEZ E, COHOBON E, SAMAYAO BE, JAUREGUI E, PERALTA E, CARRILLO G, 1995
Antigonorrhoeal activity of plants used in Guatemala for the treatment of sexually transmitted diseases. J Ethnopharmacol 48(2):85-88.
18 PÉREZ C, SUÉREZ C, 1997
Antifungal activity of plant extracts against Candida albicans. Amer J Chinese Med 25(2):181-184.
19 HUSSAIN HS, DEENI YY, 1991
Plants in Kano ethomedicine; screening for antimicrobial activity and alkaloids. Int J Pharmacog 29(1):51-56.
20 SCHMEDA-HIRSCHMANN G, ROJAS DE ÁRIAS A, 1992
A screening method for natural products on triatomine bugs. Phytother Res 6(2):68-73.
21 TONA L, NGIMBI NP, TSAKALA M, MESIA K, CIMANGA K, ASPERS S, DE BRUYNE T, PIETERS L, TOTTE J, VLIETINCK AJ, 1999
Antimalarial activity of 20 crude extracts from nine African medicinal plants used in Kinshasa, Congo. J Ethnopharmacol 68(1/3):193-203.
22 SADIQUE J, CHANDRA T, THENMOZHI V, ELANGO V, 1987
Biochemical modes of action of Cassia occidentalis and Cardiospermum halicacabum in inflammation. J Ethnopharmacol 19(2):201-212.
23 SARAF S, DIXIT VK, TRIPATHI SC, PATNAIK GK, 1994
Antihepatotoxic activity of Cassia occidentalis. Int J Pharmacog 32(2):178-183.
24 JAFRI MA, JALIS SUBHANI M, JAVED K, SINGH S, 1999
Hepatoprotective activity of leaves of Cassia occidentalis against paracetamol and ethyl alcohol intoxication in rats. J Ethnopharmacol 66(3):355-361.
25 FENG PC, HAYNES LJ, MAGNUS KE, PLIMMER JR, SHERRAT HS, 1962
Pharmacological screening of some West Indian medicinal plants. J Pharm Pharmacol 14:556-561.
26 GARCÍA GM, COTO MT, GONZÁLEZ CS, PAZOS L, 1998
Toxicidad sub-crónica en ratones, del extracto acuoso de hojas frescas de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
27 GARCÍA GM, COTO MT, GONZÁLEZ CS, PAZOS L, 1998
Toxicidad sub-crónica en ratones, del extracto acuoso de raíz fresca de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
28 GONZÁLEZ A, ALFONSO H, 1990
Evaluación de la toxicidad dérmica de Momordica charantia L. y Cassia occidentalis L. en conejo y cobayo. Informe TRAMIL. Centro Nacional de Salud Animal, La Habana, Cuba.
29 PAZOS L, COTO T, GONZÁLEZ S, 2003
Estudio de irritabilidad dérmica, en piel lesionada de conejo, de hoja fresca de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
30 PAZOS L, COTO T, GONZÁLEZ S, 2003
Irritabilidad de la mucosa en conejo, de raíz fresca de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
31 PAZOS L, COTO T, GONZÁLEZ S, 2003
Irritabilidad de la mucosa en conejo, de semillas frescas de Senna occidentalis. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
32 O'HARA P, PIERCE K, 1974
A toxic cardiomyopathy caused by Cassia occidentalis. II Biochemical studies in poisoned rabbits. Vet Pathol 11(2):110-124.
33 COLVIN BM, HARRISON LR, SANGSTER LT, GOSSER HS, 1986
Cassia occidentalis toxicosis in growing pigs. J Am Vet Med Assoc 189(4):423-426.
34 MARTINS E, MARTINS VM, RIET-CORREA F, SONCINI RA, PARABONI SV, 1986
Intoxicação por Cassia occidentalis (Leguminosae) em suínos. Pesq Vet Bras 6(2):35-38.
35 BARTH AT, KOMMERS GO, SALLES MS, WOUTERS F, DE BARROS CS, 1994
Coffee senna (Senna occidentalis) poisoning in cattle in Brazil. Vet Hum Toxicol 36(6):541-545.
36 ALBORNOZ A, 1993
Medicina Tradicional Herbaria. Caracas, Venezuela: Editorial Instituto Farmacoterápico Latino S.A. p174.