Brassica rapa
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Dominica:
- turnip
Distribución geográfica
Originaria de Eurasia. Ampliamente cultivada en regiones templadas.
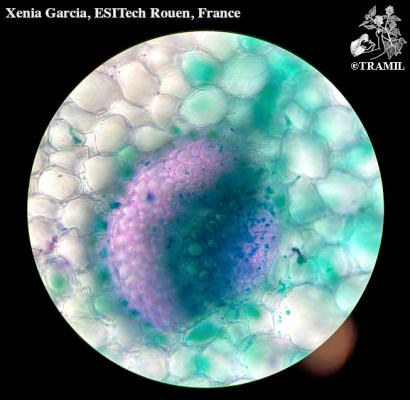
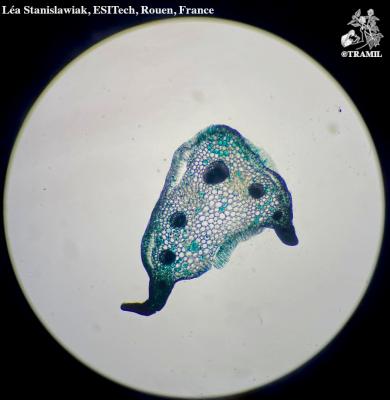
Descripción botánica
Herbácea bienal. Raíz típicamente globosa o elongada, de color exterior blanco, blanco con púrpura o amarillento. Casi sin tallo antes de florecer. Hojas de hasta 30 cm de largo, glaucas, a veces liradas. Tallo de inflorescencia con hojas lobuladas. Flores con 4 pétalos amarillos, dispuestas en racimos corimbosos.
Voucher(s)
Jiménez,693,JBSD
Farmacopea
Ed.3References
1 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
2 TSUMURAYA Y, NAKAMURA K, HASHIMOTO Y, YAMAMOTO S, 1984
Immunological properties of arabinogalactan proteins from leaves of cruciferous plants. Agr Biol Chem 48(11):2915-2917.
3 GUSTINE DL, 1985
Determination of S-methyl cysteine sulfoxide in Brassica extracts by high-performance liquid chromatography. J Chromatogr 319(3):450-453.
4 IGARASHI K, ABE S, SATOH J, 1990
Effects of atsumi-kabu (red turnip, Brassica campestris L.) anthocyanin on serum cholesterol levels in cholesterol-fed rats. Agr Biol Chem 54(1):171-175.
5 YAO G, LI YJ, CHANG XQ, LU J, 1983
Vitamin C content in vegetables and fruits in Shenyang (China) market during four seasons. Yingyang Xuebao 5(4):373-379.
6 TAWFIQ N, HEANEY RK, PLUMB JA, FENWICK GR, MUSK SR, WILLIAMSON G, 1995
Dietary glucosinolates as blocking agents against carcinogenesis: glucosinolate breakdown products assessed by induction of quinone reductase activity in murine hepa1c1c7 cells. Carcinogenesis 16(5):1191-1194.
7 DUKE JA, 1992
Handbook of biologically active phytochemical constituents of GRAS herbs and other economic plants. Boca Raton, USA: CRC Press.
8 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p30.
9 EL-SAYED AM, EL-SAKHEWY FS, 1993
Furochromone and thiooxazolidone principles of Brassica rapa (Turnip). Az J Pharm Sco 11(6):11-20.
10 BADRIA FA, 1994
Is man helpless against cancer? An environmental approach: antimutagenic agents from Egyptian food and medicinal preparations. Cancer Lett 84(1):1-5.
11 MORITA K, HARA M, KADA T, 1978
Studies on natural desmutagens: Screening for vegetable and fruit factors active in inactivation of mutagenic pyrolysis products from amino acids. Agr Biol Chem 42(6):1235-1238.
12 KADA T, MORITA K, INOUE T, 1978
Anti-mutagenic action of vegetable factor(s) on the mutagenic principle of tryptophan pyrolysate. Mutat Res 53(3):351-353.
13 YAMAGUCHI T, YAMASHITA Y, ABE T, 1980
Desmutagenic activity of peroxidase on autoxidized linolenic acid. Agr Biol Chem 44(4):959-961.
14 KRAMER J, MAHADEVAN S, HUNT JR, SAUER FD, CORNER AH, CHARLTON KM, 1973
Growth rate, lipid composition, metabolism and myocardial lesions of rats fed rapeseed oils (Brassica campestris var. arlo, Echo and Span, and B. napus var. oro.) J Nutr 103(12):1696-1708.
15 KRAMER J, FRIEND D, HULAN H, 1975
Lipid changes in tissue of young boars fed rapeseed oil or corn oil. Nutr Metab 19(5-6):279-290.
16 KRAMER JK, HULAN HW, MAHADEVAN S, SAUER FD, CORNER AH, 1975
Brassica campestris var. span: II. Cardiopathogenicity of fractions isolated from span rapeseed oil when fed to male rats. Lipids 10(9):511-516.
17 GRANDHI RR, SLINGER SJ, SUMMERS JP, 1977
Productive performance and liver lesions in two strains of laying hens receiving two rapeseed meals. Poult Sci 56(6):1904-1908.
18 SARKAR SR, SINGH LR, UNIYAL BP, MUKHERJEE SK, NAGPAL KK, 1983
Effect of common vegetables on thyroid function in rats. A preliminary study. Def Sci J 33(4):317-321.
19 GREER MA, ASTWOOD EB, 1948
The antithyroid effect of certain foods in man as determined with radioactive iodine. Endocrinology 43:105-119.