Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Antigua-et-Barbuda:
- ginger
Barbade:
- ginger
Dominique:
- ginger
Porto Rico:
- ginger
- jengibre
Saint-Vincent-et-les-Grenadines:
- ginger
Sainte-Lucie:
- ginger
Guatemala:
- jengibre
Honduras:
- jengibre
Vénézuéla:
- jengibre
Costa Rica:
- jengibre
Distribution géographique
Originaire d’Asie tropicale, cultivée dans les régions tropicales et subtropicales.
Description botanique
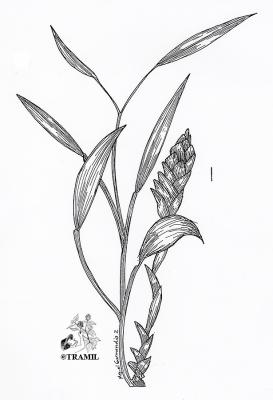
Herbacée pouvant atteindre 90 cm, avec rhizome tubéreux. Feuilles linéaires-lancéolées, sessiles, à pointe aiguë, à base cunéiforme, glabres, pouvant atteindre 20 cm de long. Epis floraux à longs pédoncules, ellipsoïdaux, denses, bractées ovées, munies d’une pointe, de couleur vert pâle; calice créné; corolle vert-jaunâtre, tube de 2 cm. Capsule à 3 valves, s’ouvrant irrégulièrement. Il existe plusieurs cultivars.
Voucher(s)
Faujour,4,BAR González,37,MAPR
Girón,286,CFEH
Ochoa,315,HPMHV
Gimenez,275697-25,VEN
Balland,42,HVB
Pharmacopée
Ed.3References
1 DELENS M, 1990
Encuesta TRAMIL en Barlovento, Edo. Miranda de Venezuela. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
2 BENEDETTI MD, 1994
Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
3 LAGOS-WITTE S, 1988-89, 1996
Encuesta TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
4 DELENS M, 1992
Encuesta TRAMIL en los Estados Lara y Sucre de Venezuela. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
5 OCAMPO R, 1988
Encuesta TRAMIL (Costa atlántica), Instituto de Desarrollo Agrario, Universidad de Costa Rica, San José, Costa Rica.
6 O'REILLY A, WILSON V, PHILLIP M, JOSEPH O, 1992
TRAMIL survey. Chemistry and Food Technology Division, Ministry of Agriculture, Dunbars, Antigua and Barbuda.
7 GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
8 PICKING D, MITCHELL S, DELGODA R, YOUNGER N, 2011
TRAMIL survey. Natural Products Institute, The Biotechnology Centre & Tropical Metabolic Research Institute, University of the West Indies, Mona, Jamaica.
9 GIRON L, 1988
Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
10 JEAN-PIERRE L, 1988
TRAMIL survey. St. Lucia national herbarium, Castries, St. Lucia.
11 FAUJOUR A, MURREY D, CHELTENHAM B, CARRINGTON S, 2003
TRAMIL survey. enda-caribbean, IICA & UAG, Saint Thomas, Barbados.
12 BALLAND V, GLASGOW A, SPRINGER F, GAYMES G, 2004
TRAMIL survey. enda-caribbean, IICA, UAG & U.PARIS XI, Saint Vincent.
13 CHARLES C, 1988
TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
14 QUILEZ AM, GARCIA D, SAENZ T, 2009
Uso racional de medicamentos a base de plantas. Guía de interacciones entre fitomedicamentos y fármacos de síntesis. Sevilla, España: 1a Edición Fundación Farmacéutica Avenzoar.
15 CANIGUERAL S, 2003
Zingiber officinalis. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Jul. 30, 2003. URL: www.masson.es/book/fitoterapia.html
16 WHO, 1999
Rhizoma zingiberis. WHO monographs on selected medicinal plants, Volume I. WHO: Geneva, Switzerland. p284.
17 TANABE M, YASUDA M, ADACHI Y, KANOY, 1991
Capillary GC-MS analysis of volatile components in Japanese gingers. Shoyakugaku Zasshi 45(4):321-326.
18 NISHIMURA O, 1995
Identification of the characteristic odorants in fresh rhizomes of ginger (Zingiber oficinale Roscoe) using aroma extract dilution analysis and modified multidimensional gas chromatography-mass spectroscopy. J Agric Food Chem 43(11):2941-2945.
19 SAKAMURA F, OGIHARA K, SUGA T, TANIGUCHI K, TANAKA R, 1986
Volatile constituents of Zingiber officinale rhizomes produced by in vitro shoot tip culture. Phytochemistry 25(6):1333-1335.
20 WU P, KUO MC, HO CT, 1990
Glycosidically bound aroma compounds in ginger (Zingiber officinale Roscoe). J Agric Food Chem 38(7):1553-1555.
21 HAGINIWA J, HARADA M, MORISHITA I, 1963
Pharmacological studies on crude drugs. VII. Properties of essential oil components of aromatics and their pharmacological effect on mouse intestine. Yakugaku Zasshi 83:624.
22 VAN BEEK TA, LELYVELD GP, 1991
Isolation and identification of the five major sesquiterpene hydrocarbons of ginger. Phytochem Anal 2(1):26-34.
23 SHIBA M, MYATA A, OKADA M, WATANABE K, 1986
Antiulcer furanogermenone extraction from ginger. Patent-Japan Kokai Tokkyo Koho-61 227,523.
24 YOSHIKAWA M, HATAKEYAMA S, CHATANI N, NISHINO Y, YAMAHARA J, 1993
Qualitative and quantitative analysis of bioactive principles in Zingiberis Rhizoma by means of high performance liquid chromatography and gas liquid chromatography. On the evaluation of Zingiberis Rhizoma and chemical change of constituents during Zingiberis Rhizoma processing. Yakugaku Zasshi 113(4):307-315.
25 TANABE M, CHEN YD, SAITO KI, KANO Y, 1993
Cholesterol biosynthesis inhibitory component from Zingiber officinale Roscoe. Chem Pharm Bull 41(4):710-713.
26 KANO Y, TANABE M, YASUDA M, 1990
On the evaluation of the preparation of Chinese medicinal prescriptions (V) diterpenes from Japanese ginger "kintoki". Shoyakugaku Zasshi 44(1):55-57.
27 KAWAKISHI S, MORIMITSU Y, OSAWA T, 1994
Chemistry of ginger components and inhibitory factors of the arachidonic acid cascade. Asc Symp Ser 547:244-250.
28 KIKUZAKI H, NAKATANI N, 1993
Antioxidant effects of some ginger constituents. J Food Sci 58(6):1407-1410.
29 KIUCHI F, IWAKAMI S, SHIBUYA M, HANAOKA F, SANKAWA U, 1992
Inhibition of prostaglandin and leukotriene biosynthesis by gingerols and diarylheptanoids. Chem Pharm Bull 40(2):387-391.
30 HARVEY DJ, 1981
Gas chromatographic and mass spectrometric studies of ginger constituents. identification of gingerdiones and new hexahydrocurcumin analogues. J Chromatogr 211(1):75-84.
31 YUSUFOGLU H, ALQASOUMI SI, 2008
High performance thin layer chromatographic analysis of 10-gingerol in Zingiber officinale extract and ginger-containing dietary supplements, teas and commercial creams. FABAD J Pharm Sci 33:199–204.
32 MASADA Y, INOUE T, HASHIMOTO K, FUJIOKA M, UCHINO C, 1974
Studies on the constituents of ginger (Zingiber officinale Roscoe) by GC-MS. Yakugaku Zasshi 94(6):735-738.
33 ANON, 1982
Analgesic formulations containing shogaol and gingerol. Patent-Japan Kokai Tokkyo Koho-82 46,914.
34 CHEN CC, ROSEN RT, HO CT, 1986
Chromatographic analyses of isomeric shogaol compounds derived from isolated gingerol compounds of ginger (Zingiber officinale Roscoe). J Chromatogr 360:175-184.
35 SCHWERTNER HA, RIOS DC, 2007
High-performance liquid chromatographic analysis of 6-gingerol, 8-gingerol, 10-gingerol, and 6-shogaol in ginger-containing dietary supplements, spices, teas, and beverages. J of Chromatography B856(1-2):41-47.
36 HARTMAN M, 1971
Chemical composition of certain products from ginger (Zingiber officinale). Zivocisna Vyroba 16(10/11):805-812.
37 SCHULTZ JM, HERRMANN K, 1980
Occurrence of hydroxybenzoic acids and hydroxycinnamic acid in spices. IV. Phenolics of spices. Z Lebensm-Unters Forsch 171:193-199.
38 FU HY, HUANG TC, HO CT, DAUN H, 1993
Characterization of the major anthocyanin in acidified green ginger (Zingiber officinale Roscoe). Zhongguo Nongye Huaxue Huizhi 31(5):587-595.
39 NELSON EK, 1920
Constitution of capsaicin, the pungent principle of ginger. II. J Amer Chem Soc 42:597-599.
40 LIN ZK, HUA YF, 1987
Chemical constituents of the essential oil from Zingiber officinale Roscoe. of Sichuan. You-Ji Hua Hsueh 6:444-448.
41 ERLER J, VOSTROWSKY O, STROBEL H, KNOBLOCH K, 1988
Essential oils from ginger (Zingiber officinalis Roscoe). Z Lebensm-Unters Forsch 186(3):231-234.
42 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p172.
43 KIUCHI F, SHIBUYA M, KINOSHITA T, SANKAWA U, 1983
Inhibition of prostaglandin biosynthesis by the constituents of medicinal plants. Chem Pharm Bull 31(10):3391-3396.
44 SRIVASTAVA KC, 1984
Aqueous extracts of onion, garlic and ginger inhibited platelet aggregation and altered arachidonic acid metabolism. Biomed Biochim Acta 43(8/9):5335-5346.
45 ADACHI I, YASUTA A, MATSUBARA T, UENO M, TERASAWA K, HORIKOSHI I, 1984
Macrophage procoagulant activity. Effects of hot water extracts of several Kanpo-prescriptions on macrophage procoagulant activity, I. Yakugaku Zasshi 104(9):959-965.
46 PODLOGAR JA, VERSPOHL EJ, 2012
Antiinflammatory effects of ginger and some of its components in human bronchial epithelial (BEAS-2B) cells. Phytother Res 26(3):333-336.
47 KUO PL, HSU YL, HUANG MS, TSAI MJ, KO YC, 2011
Ginger suppresses phthalate ester-induced airway remodeling. J Agric Food Chem 59(7):3429-3438.
48 MASCOLO N, JAIN R, JAIN SC, CAPASSO F, 1989
Ethnopharmacologic investigation of ginger (Zingiber officinale). J Ethnopharmacol 27(1/2):129-140.
49 WOO W, LEE E, HAN B, 1979
Biological evaluation of Korean medicinal plants. III. Arch Pharm Res 2(2):127-188.
50 MAY G, WILLUHN G, 1978
Antiviral activity of aqueous extracts from medicinal plants in tissue cultures. Arzneim-Forsch 28(1):1-7.
51 ADEWUNMI CO, 1984
Natural products as agents of schistosomiasis control in Nigeria: A review of progress. Int J Crude Drug Res 22(4):161-166.
52 FEROZ H, KHARE AK, SRIVASTAVA MC, 1982
Review of scientific studies on anthelmintics from plants. J Sci Res Pl Med 3:6-12.
53 PANTHONG A, SIVAMOGSTHAM P, 1974
Pharmacological study of the action of ginger (Zingiber officinale Roscoe) on the gastrointestinal tract. Chien Mai Med Bull 13(1):41-53.
54 KASAHARA Y, SAITO E, HIKINO H, 1983
Pharmacological actions of Pinellia tubers and Zingiber rhizomes. Shoyakugaku Zasshi 37(1):73-83.
55 SAKAI K, MIYAZAKI Y, YAMANE T, SAITOH Y, IKAWA C, NISHIHATA T, 1989
Effect of extracts of Zingiberaceae herbs on gastric secretion in rabbits. Chem Pharm Bull 37(1):215-217.
56 MINAIYAN M, GHANNADI A, KARIZMADEH A, 2006
Anti-ulcerogenic effect of ginger (rhizome of Zingiber officinale Roscoe) on cystemine induced duodenal ulcer in rats. DARU J of Pharmaceutical Sciences 14(2):97-101.
57 MOWREY DB, CLAYSON DE, 1982
Motion sickness, ginger and psychophysics. Lancet 82(1):655-657.
58 GRONTVED A, BRASK T, KAMBSKARD J, HENTZER E, 1988
Ginger root against seasickness. A controlled trial on the open sea. Acta Otolaryngol (Stockholm) 105(1/2):45-49.
59 HOLTMANN S, CLARKE AH, SCHERER H, HOHN M, 1989
The anti-motion sickness mechanism of ginger. A comparative study with placebo and dimenhydrinate. Acta Otolaryngol (Stockholm) 108(3/4):168-174.
60 WOOD CD, MANNO JE, WOOD MJ, MANNO BR, MIMS ME, 1988
Comparison of efficacy of Ginger with various antimotion sickness drug. Clin Res Pract Drug Reg Affairs 6(2):129-136.
61 FISCHER-RASMUSSEN W, KJAER SK, DAHL C, ASPING U, 1991
Ginger treatment of hyperemesis gravidarum. Eur J Obstetr Gynecol Reprod Biol 38(1):19-24.
62 PILLAI AK, SHARMA KK, GUPTA YK, BAKHSHI S, 2011
Anti-emetic effect of ginger powder versus placebo as an add-on therapy in children and young adults receiving high emetogenic chemotherapy. Pediatr Blood Cancer. 56(2):234-238.
63 PERIS JB, STUBING G, 2003
Zingiber officinalis. Vademecum de Fitoterapia, Editorial Masson, Barcelona, España, Jul. 30, 2003. URL: www.masson.es/book/fitoterapia.html
64 BETANCOURT J, MARTINEZ MJ, LOPEZ M, MOREJON Z, BARCELO H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORON F, 2000
Toxicidad aguda clásica de rhizome de Zingiber officinalis Roscoe. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
65 BETANCOURT J, MARTINEZ MJ, LOPEZ M, MOREJON Z, BOUCOURT E, MORON F, 2000
Actividad genotóxica in vitro de rhizome de Zingiber officinalis Roscoe. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
66 CARBALLO A, 1995
Plantas medicinales del Escambray cubano. Informe TRAMIL. Laboratorio provincial de producción de medicamentos, Sancti Spiritus, Cuba.
67 SHALABY MA, HAMOWIEH AR, 2010
Safety and efficacy of Zingiber officinale roots on fertility of male diabetic rats. Food and Chemical Toxicology 48(10):2920–2924.
68 ASWAL BS, BHAKUNI DS, GOEL AK, KAR K, MEHROTRA BN, MUKHERJEE KC, 1984
Screening of Indian plants for biological activity: Part X. Indian J Exp Biol 22(6):312-332.
69 EMIG H, 1931
The pharmacological action of ginger. J Amer Pharm Ass 20:114-116.
70 ANON (Select Committee on GRAS Substances), 1976
GRAS status of foods and food additives. Washington DC, USA: Food and Drug Administration, Department of Health and Human Services, Office of the Federal Register National Archives and Records Administration 41, 38644.
71 KUMAZAWA Y, TAKIMOTO H, MIURA SI, NISHIMURA C, YAMADA A, KAWAKITA T, NOMOTO K, 1988
Activation of murine peritoneal macrophages by intraperitoneal administration of a traditional Chinese herbal medicine, Xiao-Chai-Hu-Tang (Japanese name: Shosaiko-To). Int J Inmunopharmacol 10(4):395-403.