Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Cuba:
- guisazo de caballo
Distribución geográfica
Cosmopolita.
Descripción botánica
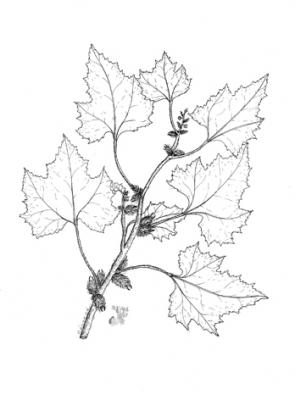
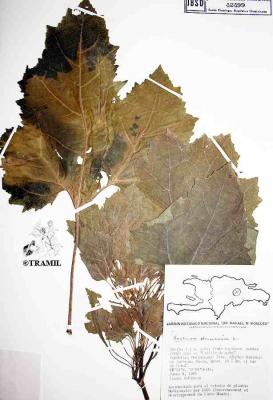
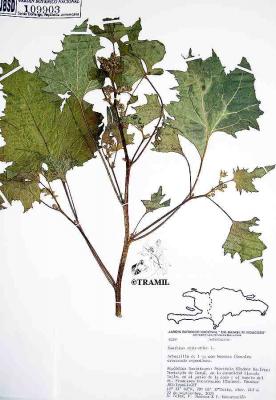
Hierba anual de hasta 2 m de altura. Tallo áspero o rugoso. Hojas anchamente ovadas o suborbiculares de 3 a 5 lóbulos, con la base más o menos cordada, de 8 a 18 cm de largo y dentadas. Cabezuelas masculinas en el ápice de las ramas y en las axilas de las hojas; cabezuelas femeninas una o pocas en la base de las inflorescencias, con brácteas ganchudas. Fruto capsular, ovoide y espinoso; espinas rectas y ganchudas en el ápice.
Voucher(s)
Soberats,TR9008,CIFMT
Fuentes,4785,ROIG
Farmacopea
Ed.3References
1 CARBALLO A, 1990
Encuesta TRAMIL. Centro de investigación de fitoterapia y medicina tradicional de Topes de Collantes, Trinidad, Cuba.
2 MOREJÓN Z, LÓPEZ M, GARCÍA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORÓN F, BOULOGNE I, GERMOSÉN-ROBINEAU L, 2009
Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Ciudad de La Habana, Cuba.
3 BISHT NP, SINGH R, 1979
Chemical constituents of the stem and roots of Xanthium strumarium. J Indian Chem Soc 56:108-109.
4 CARVAJAL D, CASACO A, GONZÁLEZ R, 1986
Actividad diurética e hipotensora de cuatro especies de plantas con reportes en medicina popular. Rev CENIC 17(1-2):34-36.
5 JIMÉNEZ L, LEÓN MC, HERRERA R, GARCÍA G, CADENAS JL, 1999
Efecto diurético de Xanthium strumarium L (guisazo de caballo). Rev Cubana Plantas Med 4(1):22-25.
6 HERRERA R, AGUERO ME, 2000
Efecto diurético de Xanthium strumarium L. en ratas. Archivo Médico de Camagüey (Supl. Med Nat y Trad).
7 KUO YC, SUN CM, TSAI WJ, OU JC, CHEN WP, LIN CY, 1998
Chinese herbs as modulators of human mesangial cell proliferation: preliminary studies. J Lab Clin Med 132(1):76-85.
8 JIMÉNEZ L, LEÓN MC, HERRERA R, GARCÍA G, CADENAS JL, LÓPEZ C, 1999
Toxicidad aguda oral del Xanthium strumarium L (guisazo de caballo). Rev Cubana. Plantas Med 4(1):40-43.
9 DHAR ML, DHAR MM, DHAWAN BN, MEHROTRA BN, RAY C, 1968
Screening of Indian plants for biological activity: part I. Indian J Exp Biol 6(4):232-247.
10 DÍAZ GARCÍA GM, 2002
Evaluación del efecto genotóxico del Xantium strumarium L (guisazo de caballo) (Tesis). Instituto Superior de Ciencias Médicas “Carlos J. Finlay”, Camagüey, Cuba.