Noms vernaculaires
(dans les territoires avec usage significatif TRAMIL)
Cuba:
- guisazo de caballo
Distribution géographique
Cosmopolite.
Description botanique
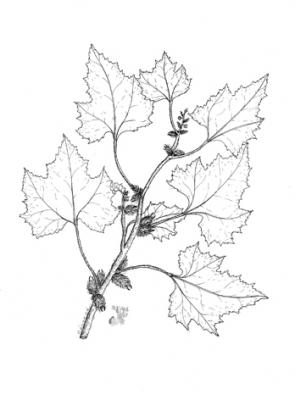
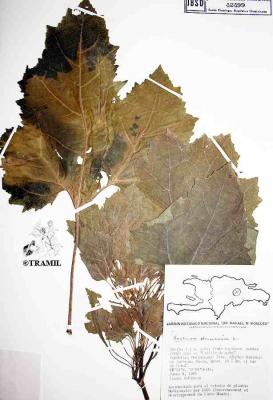
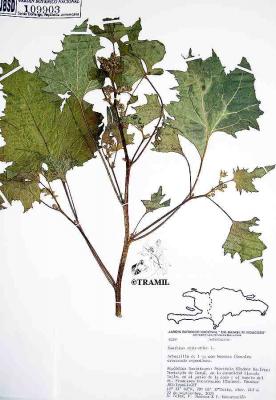
Herbe annuelle pouvant atteindre 2 m de haut. Tige âpre ou rugueuse. Feuilles largement ovées ou suborbiculaires de 3 à 5 lobes, à base plus ou moins cordée, de 8 à 18 cm de long, dentées. Capitules mâles à la pointe des branches et à l’axe des feuilles; capitules femelles au nombre d’un ou un peu plus à la base des inflorescences, avec bractées en forme de crochets. Fruit à capsule, ovoïde et épineux; épines droites et crochues à la pointe.
Voucher(s)
Soberats,TR9008,CIFMT
Fuentes,4785,ROIG
Pharmacopée
Ed.3References
1 CARBALLO A, 1990
Encuesta TRAMIL. Centro de investigación de fitoterapia y medicina tradicional de Topes de Collantes, Trinidad, Cuba.
2 MOREJON Z, LOPEZ M, GARCIA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORON F, BOULOGNE I, ROBINEAU L, 2009
Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Cuba.
3 BISHT NP, SINGH R, 1979
Chemical constituents of the stem and roots of Xanthium strumarium. J Indian Chem Soc 56:108-109.
4 CARVAJAL D, CASACO A, GONZALEZ R, 1986
Actividad diurética e hipotensora de cuatro especies de plantas con reportes en medicina popular. Rev CENIC 17(1-2):34-36.
5 JIMENEZ L, LEON MC, HERRERA R, GARCIA G, CADENAS JL, 1999
Efecto diurético de Xanthium strumarium L (guisazo de caballo). Rev Cubana Plantas Med 4(1):22-25.
6 HERRERA R, AGUERO ME, 2000
Efecto diurético de Xanthium strumarium L. en ratas. Archivo Médico de Camagüey (Supl. Med Nat y Trad).
7 KUO YC, SUN CM, TSAI WJ, OU JC, CHEN WP, LIN CY, 1998
Chinese herbs as modulators of human mesangial cell proliferation: preliminary studies. J Lab Clin Med 132(1):76-85.
8 JIMENEZ L, LEON MC, HERRERA R, GARCIA G, CADENAS JL, LOPEZ C, 1999
Toxicidad aguda oral del Xanthium strumarium L (guisazo de caballo). Rev Cubana. Plantas Med 4(1):40-43.
9 DHAR ML, DHAR MM, DHAWAN BN, MEHROTRA BN, RAY C, 1968
Screening of Indian plants for biological activity: part I. Indian J Exp Biol 6(4):232-247.
10 DIAZ GARCIA GM, 2002
Evaluación del efecto genotóxico del Xantium strumarium L (guisazo de caballo) (Tesis). Instituto Superior de Ciencias Médicas “Carlos J. Finlay”, Camagüey, Cuba.