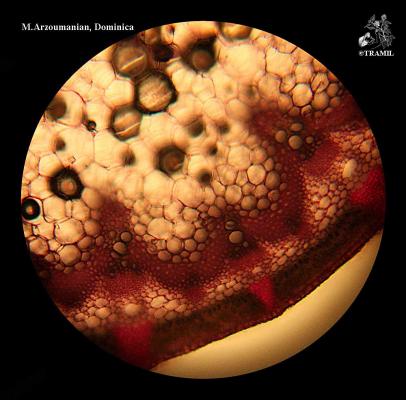
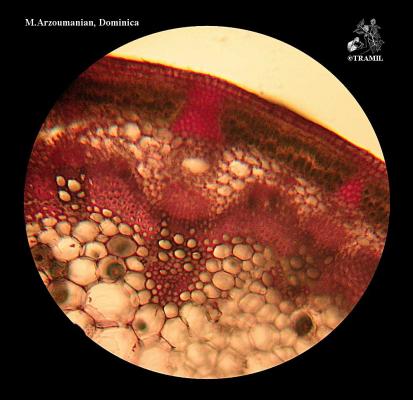
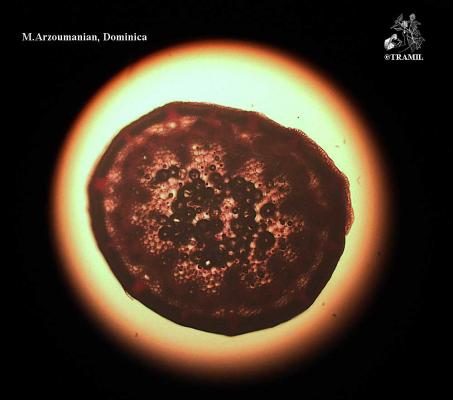
Nombres vernáculos
(en territorios con usos significativos TRAMIL)
Haití:
- anni
Santo Domingo:
- hinojo
Distribución geográfica
Nativa de la región mediterránea, cultivada y con frecuencia naturalizada en las regiones templadas y subtropicales del mundo.
Descripción botánica
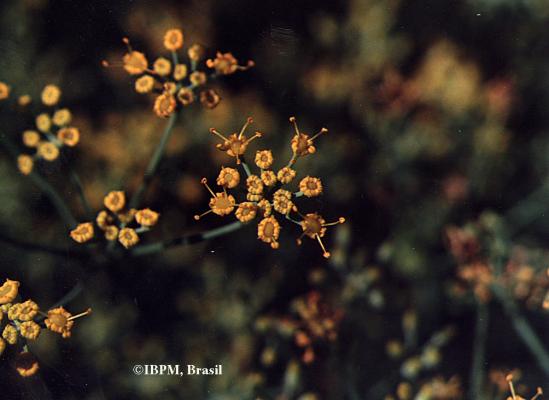
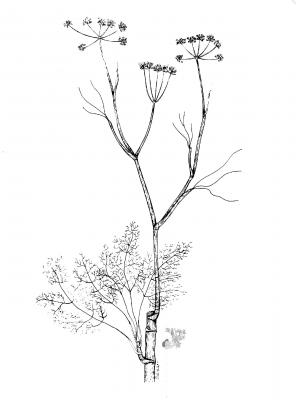
Herbácea erecta perenne, glabra, comúnmente muy ramificada. Hojas alternas, ovadas a deltoideas, de hasta 30 cm, pinnati-compuestas, con divisiones filiformes; vainas peciolares de 3-10 cm de longitud. Inflorescencia en umbelas con muchas flores, de hasta 12 cm de diámetro; pétalos amarillos. Fruto oblongo, glabro, ligeramente compreso, con costillas agudas e iguales.
Con frecuencia esta especie es confundida con Anethum graveolens, la cual tiene una vaina peciolar más corta y las costillas del fruto estrechamente aladas, las 2 laterales más amplias.
Voucher(s)
Jiménez,688,JBSD
Martínez,4623,ROIG
Farmacopea
Ed.3References
1 GERMOSÉN-ROBINEAU L, GERÓNIMO M, AMPARO C, 1984
Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
2 WENIGER B, ROUZIER M, 1986
Enquête TRAMIL. Service Oecuménique d'Entraide SOE, Port au Prince, Haïti.
3 HAGINIWA J, HARADA M, MORISHITA I, 1963
Pharmacological studies on crude drugs. VII. Properties of essential oil components of aromatics & their pharmacological effect on mouse intestine. Yakugaku Zasshi 83:624.
4 AKUNZEMANN J, HERRMANN K, 1977
Isolation and identification of flavon(ol)-O-glycosides in caraway (Carum carvi L.), fennel (Foeniculum vulgare Mill.), anise (Pimpinella anisum L.), and coriander (Coriandrum sativum L.), and of flavone-C-glycosides in anise. I. Phenolics of spices. Z Lebensm Unters Forsch 164:194-200.
5 HARANATH P, AKTHER M, SHARIF S, 1987
Acetylcholine and choline in common spices. Phytother Res 1(2):91-92.
6 ZOBEL A, BROWN S, 1991
Psoralens on the surface of seeds of Rutaceae and fruits of Umbelliferae and Leguminosae. Can J Bot 69(3):485-488.
7 CESKA O, CHAUDHARY S, WARRINGTON P, ASHWOOD-SMITH M, 1987
Photoactive furocoumarins in fruits of some Umbellifers. Phytochemistry 26(1):165-169.
8 MENDEZ J, CASTRO-POCEIRO J, 1981
Coumarins in Foeniculum vulgare fruits. Rev Latinoamer Quim 12(2):91-92.
9 SALEH N, EL-NEGOUMY S, EL-HADIDI M, HOSNI H, 1983
Comparative study of the flavonoids of some local members of the Umbelliferae. Phytochemistry 22(6):1417-1420.
10 LATTANZIO V, MARCHESINI A, 1981
Determination of plant phenols by gel filtration. J Food Sci 46(6):1907-1909.
11 HARBONE J, BOARDLEY M, 1984
Use of high-performance liquid chromatography in the separation of flavonol glycosides and flavonol sulphates. J Chromatogr 299(2):377-385.
12 DUKE JA, ATCHLEY AA, 1986
Handbook of proximate analysis tables of higher plants. Boca Ratón, USA: CRC Press. p75.
13 CARBALLO A, 1995
Plantas medicinales del Escambray cubano. Informe TRAMIL. Laboratorio provincial de producción de medicamentos, Sancti Spiritus, Cuba.
14 MALINI T, VANITHAKUMARI G, MEGALA N, ANUSYA S, DEVI K, ELANGO V, 1985
Effect of Foeniculum vulgare Mill. seed extract on the genital organs of male and female rats. Indian J Physiol Pharmacol 29(1):21-26.
15 MASCOLO N, AUTORE G, CAPASSO F, MENGHINI A, FASULO MP, 1987
Biological screening of Italian medicinal plants for anti-inflammatory activity. Phytother Res 1(1):28-31.
16 DUKE JA, 1988
Handbook of medicinal herbs. Boca Raton, USA: CRC Press.
17 PINKAS M, BEZANGER-BEAUQUESNE L, 1986
Les plantes dans la thérapeutique moderne. Paris, France : 2 éd. Ed. Maloine.
18 ALBERT PULEO M, 1980
Fennel and anise as estrogenic agents. J Ethnopharmacol 2(4):337-344.
19 HURTADO M, CARBALLO A, 1990
Las plantas medicinales TRAMIL en la farmacopea soviética. Centro de Investigaciones de Fitoterapia y Medicina Tradicional, Topes de Collantes, Cuba.
20 ALFONSO H, 1992
Evaluación de la toxicidad dérmica de Momordica charantia L., Foeniculum vulgare Mill y Cassia occidentalis L. en cobayos. Informe tramil. Centro Nacional de Salud Animal CENSA, La Habana, Cuba.
21 MARTINEZ MJ, LOPEZ M, MOREJÓN Z, BOUCOURT E, FUENTES V, MORÓN F, 2007
Irritabilidad dérmica primaria del zumo de hojas frescas machacadas y exprimidas mediante gasa de Foeniculum vulgaris Mill. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
22 MARTINEZ MJ, MOREJÓN Z, LOPEZ M, BOUCOURT E, FUENTES V, MORÓN F, 2005
Clases tóxicas agudas (CTA) de una decocción de hoja fresca de Foeniculum vulgare Miller. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
23 SHAH A, QURESHI S, AGEEL A, 1991
Toxicity studies in mice of ethanol extracts of Foeniculum vulgare fruit and Ruta chalepensis aerial parts. J Ethnopharmacol 34(2/3):167-172.
24 HUSSAIN RA, POVEDA LJ, PEZZUTO JM, SOEJARTO DD, KINGHORN AD, 1990
Sweetening agents of plant origin: phenylpropanoid constituents of seven sweet-tasting plants. Econ Bot 44(2):174-182.
25 SEETHARAM K, PASRICHA J, 1987
Condiments and contact dermatitis of the finger-tips. Indian J Dermatol Venereol Leprol 53(6):325-328.
26 ASSOCIATION SCIENTIFIC COMMITTEE, 1983
British herbal pharmacopœia. Bournemouth, England: British Herbal Medicine Association.
27 CARBALLO A, 1995
Cálculo de concentración y dosis de las drogas vegetales TRAMIL: Mensuraciones farmacognósticas y aproximaciones técnico-clínicas. Laboratorio provincial de producción de medicamentos, Sancti Spiritus, Cuba.